题目内容
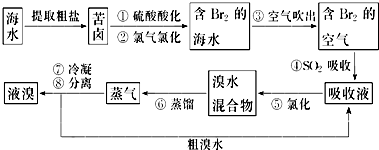
15.黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料.某化学兴趣小组对该黄铁矿石进行如下实验探究.将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全.
其反应的化学方程式为:
4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2
4FeS+7O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4SO2
【实验一】:测定硫元素的含量反应结束后,将乙瓶中的溶液进行如下处理:
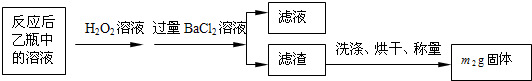
(1)鼓入空气的作用是提供反应需要的氧气,排出装置中生成的二氧化硫被乙装置全部吸收.
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是Na2SO3+H2O2=Na2SO4+H2O(用化学方程式表示).
(3)该黄铁矿石中硫元素的质量分数为$\frac{32{m}_{2}}{233{m}_{1}}$×100%(列出表达式即可).
【实验二】:测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣→②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤→③将滤液稀释至250mL→④取25.00mL稀释液用0.1 000mol/L的酸性KMnO4溶液滴定
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量偏大(填“偏大”、“偏小”或“无影响”).
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有250mL容量瓶.
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
分析 (1)鼓入空气提供反应需要的氧气,排出装置中生成的二氧化硫被乙装置全部吸收;
(2)为减少实验误差,最后使完全转化成SO42-,从而完全生成硫酸钡沉淀;双氧水足量将亚硫酸根离子完全转化;
(3)根据硫原子守恒计算硫铁矿中硫的质量,从而计算其质量分数;
(4)铁和铁离子反应生成的亚铁离子物质的量增大;
(5)根据一定物质的量浓度溶液的配制中各仪器的作用选取仪器;
(6)依据实验过程和滴定实验消耗的高锰酸钾溶液体积的平均数,结合氧化还原反应离子方程式计算亚铁离子物质的量,计算25mL溶液中亚铁离子的浓度.
解答 解:(1)鼓入空气提供反应需要的氧气,排出装置中生成的二氧化硫被乙装置全部吸收;
故答案为:提供反应需要的氧气,排出装置中生成的二氧化硫被乙装置全部吸收;
(2)为使亚硫酸根离子完全转化为硫酸根离子,加入的双氧水要足量,发生的反应的化学方程式为:Na2SO3+H2O2=Na2SO4+H2O;
故答案为:Na2SO3+H2O2=Na2SO4+H2O;
(3)最终所得沉淀是硫酸钡,根据硫原子守恒得硫的质量,设硫的质量为x,
S-----BaSO4
32g 233g
x m2g
x=$\frac{32m{\;}_{2}}{233}$g
质量分数=$\frac{32{m}_{2}}{233{m}_{1}}$×100%;
故答案为:$\frac{32{m}_{2}}{233{m}_{1}}$×100%;
(4)铁和铁离子反应生成的亚铁离子物质的量增大,用高锰酸钾物质的量增大,测定结果偏大,
故答案为:偏大;
(5)④中取稀释液25.00ml,溶液是酸性溶液,体积数据要求到小数点后两位,需用的仪器是酸式滴定管,Ⅲ的步骤③中,一定物质的量浓度溶液的配制中,除了烧杯、玻璃棒、胶头滴管外,还需要250mL容量瓶,
故答案为:250mL容量瓶;
(6)滴定过程中高锰酸钾溶液平均消耗体积=$\frac{25ml+25.03ml+24.97ml}{3}$=25mL,
氧化还原反应为:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O,设亚铁离子物质的量为x,则
5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O
5 1
x 0.1mol/L×0.025L
x=0.0125mol;
c(Fe2+)=$\frac{0.0125mol}{0.025L}$=0.5000mol/L;
故答案为:0.5000mol/L.
点评 本题考查了探究物质的含量实验,滴定实验的方法和计算,溶液配制方法和仪器的使用方法,根据元素化合物的性质来分析解答即可,难度中等,注意为防止空气中二氧化碳的干扰.

 阅读快车系列答案
阅读快车系列答案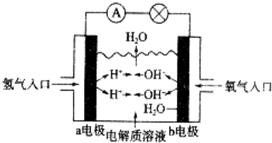
| A. | a电极为负极 | |
| B. | b电极的电极反应式为4OH-→2H2O+O2↑+4e- | |
| C. | 氢氧燃料电池是一种具有应用前景的绿色电源 | |
| D. | 氢氧燃料电池是一种不需要将氧化剂和还原剂全部储藏在电池内的新型发电装置 |
| A. | 冰与水共存物属于混合物 | B. | 冰的密度比水大 | ||
| C. | 冰与二氧化硅的晶体类型相似 | D. | 氢键在冰晶体结构中起关键作用 |
| A. | 氨气 | B. | 氮气 | C. | 一氧化氮 | D. | 硝酸 |
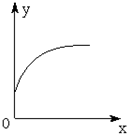 在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)?3C(g);△H<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)?3C(g);△H<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )| X | Y | |
| A | 增大压强 | C的体积分数 |
| B | 使用催化剂 | C的平衡浓度 |
| C | 充入A | B的转化率 |
| D | 降低温度 | 超过活化能Ea的活化分子百分数 |
| A. | A | B. | B | C. | C | D. | D |


 ;
; CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.