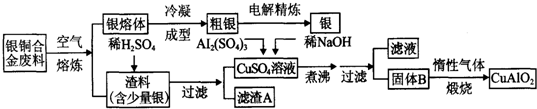
题目内容
15.已知反应2SO2(g)+O2(g)?2SO3(g),在一定条件下,向2L密闭容器中充入一定物质的量的SO2和O2,2min时,测得n(SO3)=2mol,c(SO2)=0.5mol•L-1 ,下列说法正确的是( )| A. | 起始时,n(SO2)=2.5mol | B. | 起始时,c(O2)=0.5mol•L-1 | ||
| C. | 0~2min,v(SO3)=0.5mol•L-1•min-1 | D. | 0~2min,O2的转化率为50% |
分析 由反应方程式:2SO2(g)+O2(g)?2SO3(g),
起始量:3mol 0
变化量:2mol 1mol 2mol
平衡量:0.5×2mol 2mol,
A、起始时,n(SO2)=3mol;
B、起始时氧气的物质的量大于1mol;
C、根据v=$\frac{△c}{△t}$进行计算求解;
D、氧气的起始量不知,所以无法求转化率.
解答 解:A、起始时,n(SO2)=2mol+1mol=3mol,而不是2.5mol,故A错误;
B、平衡时应是反应物和生成物共存的体系,所以起始时氧气的物质的量大于1mol,则起始时,c(O2)>0.5mol•L-1,故B错误;
C、根据v=$\frac{△c}{△t}$=$\frac{\frac{2mol}{2L}}{2min}$=0.5mol•L-1•min-1,故C正确;
D、氧气的起始量不知,所以无法求转化率,故D错误;
故选C.
点评 本题考查较为综合,涉及化学时物质的转化率、反应的速率等,侧重于学生对化学平衡的综合理解和应用,题目难度中等.

练习册系列答案
相关题目
5.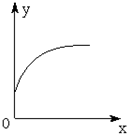 在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)?3C(g);△H<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)?3C(g);△H<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
 在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)?3C(g);△H<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)?3C(g);△H<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )| X | Y | |
| A | 增大压强 | C的体积分数 |
| B | 使用催化剂 | C的平衡浓度 |
| C | 充入A | B的转化率 |
| D | 降低温度 | 超过活化能Ea的活化分子百分数 |
| A. | A | B. | B | C. | C | D. | D |
6.设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,11.2L HF中含有分子的数目为0.5NA | |
| B. | 0.1molFe与少量氯气反应生成FeCl2,转移电子数为0.2NA | |
| C. | 1.4g 由乙烯和环丙烷组成的混合物中含有原子的数目为 0.3NA | |
| D. | 0.1 mol•L-1碳酸钠溶液中含有CO32-离子数目小于0.1 NA |
3.NA表示阿伏加德罗常数,下列判断正确的是( )
| A. | 6.8g熔融的KHSO4中含有阳离子数0.05NA | |
| B. | 1mol冰醋酸和lmo1乙醇经催化加热反应可生成H2O分子数为NA | |
| C. | 乙烯和环丙烷(C3H6)组成的28g混合气体中含有3NA个氢原子 | |
| D. | 常温常压下,17g羟基中含有的电子数为10NA |
4.Ⅰ制备:目前,我国采用“接触法”制硫酸,设备如图所示:
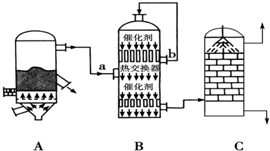
(1)图中设备A的名称是沸腾炉,B设备气流a、b温度较高的是b(填“a”或“b”),C设备中用浓硫酸吸收SO3.
(2)CuFeS2是黄铁矿的另一部分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为:4CuFeS2+13O2$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+2Fe2O3+8SO2.
Ⅱ为了回收利用SO2,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体的生产流程,其流程示意图如下:
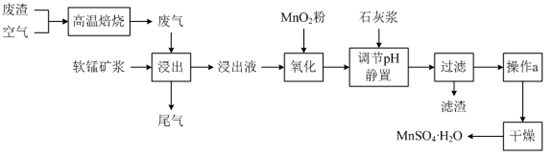
已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见下表:
请回答下列问题:
(1)写出浸出过程中主要反应的化学方程式:SO2+MnO2=MnSO4.
(2)写出氧化过程中主要反应的离子方程式:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,并用pH试纸测定调节pH,pH应调节范围是4.7≤pH<8.3.
(4)滤渣的主要成分有氢氧化铁、氢氧化铝、硫酸钙.
(5)下列各组试剂中,能准确测定尾气中SO2含量的是b、c.(填编号)
a.NaOH溶液、酚酞试液b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液d.氨水、酚酞试液.

(1)图中设备A的名称是沸腾炉,B设备气流a、b温度较高的是b(填“a”或“b”),C设备中用浓硫酸吸收SO3.
(2)CuFeS2是黄铁矿的另一部分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为:4CuFeS2+13O2$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+2Fe2O3+8SO2.
Ⅱ为了回收利用SO2,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体的生产流程,其流程示意图如下:

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(1)写出浸出过程中主要反应的化学方程式:SO2+MnO2=MnSO4.
(2)写出氧化过程中主要反应的离子方程式:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,并用pH试纸测定调节pH,pH应调节范围是4.7≤pH<8.3.
(4)滤渣的主要成分有氢氧化铁、氢氧化铝、硫酸钙.
(5)下列各组试剂中,能准确测定尾气中SO2含量的是b、c.(填编号)
a.NaOH溶液、酚酞试液b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液d.氨水、酚酞试液.