题目内容
16.下列溶液一定呈中性的是( )| A. | pH=7的溶液 | |
| B. | c(OH-)=$\sqrt{{K}_{W}}$ | |
| C. | 由强酸与强碱等物质的量反应得到的溶液 | |
| D. | 强电解质溶于水得到的溶液 |
分析 溶液的酸碱性是根据溶液中H+浓度与OH-浓度的相对大小判断.
当c(H+)>c(OH-),溶液就呈酸性;
当c(H+)=c(OH-),溶液就呈中性;
当溶液中c(H+)<c(OH-),溶液就呈碱性.
解答 解:A.常温下,水的离子积Kw=1×10-14,所以,PH<7,溶液呈酸性;PH=7,溶液呈中性;PH>7,溶液呈碱性.Kw受温度影响,水的电离是吸热的,温度越高Kw越大,如100℃时,水的离子积常数是10-12,当PH=6时溶液呈中性,当PH=7时溶液呈碱性,该选项中pH=7的溶液,不一定是在常温下,溶液中c(H+)、c(OH-)不一定相等,故A错误;
B.c(OH-)=$\sqrt{{K}_{W}}$,即c(H+)=c(OH-),溶液呈中性,故B正确;
C.由1mol强酸硫酸和1mol强碱氢氧化钠等物质的量反应,硫酸过量,制得的溶液呈酸性,故C错误;
D.强酸与强碱溶于水得到的溶液分别为酸性溶液和碱性溶液,不是中性溶液,故D错误,故选B.
点评 本题主要考查溶液的酸碱性的判断,注意不能根据溶液的pH值判断溶液的酸碱性,要根据氢离子浓度和氢氧根离子浓度的相对大小判断溶液的酸碱性,属于易错题.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
7.2015年7月31日,中国获得2022年冬奥会主办权,这将促进中国冰雪运动,以下关于冰的说法正确的是( )
| A. | 冰与水共存物属于混合物 | B. | 冰的密度比水大 | ||
| C. | 冰与二氧化硅的晶体类型相似 | D. | 氢键在冰晶体结构中起关键作用 |
4.学好自然科学知识是改造自然的基础.自然科学知识告诉我们,物质的能量越低,该物质越稳定.下列含氮物质中,能量最低的是( )
| A. | 氨气 | B. | 氮气 | C. | 一氧化氮 | D. | 硝酸 |
8.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1molNH4+ 所含质子数为10NA | |
| B. | 常温常压下,48gO2与O3混合气体中所含原子数为3NA | |
| C. | 22.4LSO2所含的分子数为NA | |
| D. | 同温同压下,体积相同的氢气和氧气所含的分子数相等 |
5.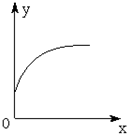 在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)?3C(g);△H<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)?3C(g);△H<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
 在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)?3C(g);△H<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )
在一密闭容器中通入A、B两种气体,一定条件下发生如下反应:2A(g)+B(g)?3C(g);△H<0,达到平衡后,只改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )| X | Y | |
| A | 增大压强 | C的体积分数 |
| B | 使用催化剂 | C的平衡浓度 |
| C | 充入A | B的转化率 |
| D | 降低温度 | 超过活化能Ea的活化分子百分数 |
| A. | A | B. | B | C. | C | D. | D |
6.设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,11.2L HF中含有分子的数目为0.5NA | |
| B. | 0.1molFe与少量氯气反应生成FeCl2,转移电子数为0.2NA | |
| C. | 1.4g 由乙烯和环丙烷组成的混合物中含有原子的数目为 0.3NA | |
| D. | 0.1 mol•L-1碳酸钠溶液中含有CO32-离子数目小于0.1 NA |

 f,e;d,i,j,g,h,b(填玻璃接口字母)
f,e;d,i,j,g,h,b(填玻璃接口字母)