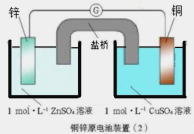
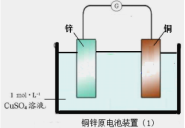
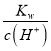题目内容
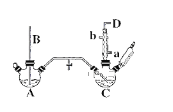
【题目】氯苯的合成工艺分为液相法和气相法两种,实验室模拟液相法的装置如下图(其中夹持仪器、加热装置及尾气处理装置已略去),有关物质的性质如表所示
名称 | 相对分子质量 | 沸点/(℃) | 密度/(g/mL) |
苯 | 78 | 78 | 0.88 |
氯苯 | 112.5 | 132.2 | 1.1 |
邻二氯苯 | 147 | 180.4 | 1.3 |
回答下列问题:
(1)A反应器是利用实验室法制取氯气,装置中中空导管B的作用是_______________。
(2)把干燥的氯气通入装有50.0mL干燥苯、少量铁屑的三颈烧瓶C中制备氯苯,写出本方法制备氯苯的化学方程式。_______________。
(3)C的反应温度不宜过高,原因为①温度过高,反应得到二氯苯;②_______________,D出口的主要尾气成分有___________________。
(4)提纯粗产品过程如下:
![]()
净化过程中加入无水CaCl2的目的是_____________。
(5)实验中最终得到产品22.5mL,产率为______________。
(6)气相法制氯苯是将空气、氯化氢气体混合物与苯在温度为210℃,迪肯型催化剂(CuCl2、FeCl3附在三氧化铝上)存在下进行氯化,发生反应生成氯苯。其反应方程式为:_______________。
【答案】平衡气压 ![]() 温度过高,苯挥发,原料利用率不高 Cl2、HCl、苯蒸气 吸水干燥 39% 2
温度过高,苯挥发,原料利用率不高 Cl2、HCl、苯蒸气 吸水干燥 39% 2![]() + 2HCl + O2
+ 2HCl + O2![]() 2
2![]() +2H2O
+2H2O
【解析】
(1)、玻璃管B伸入液面下,装置内压强过大时,可以用于平衡气压;
(2)、根据氯气、苯、铁屑作为反应物书写方程式;
(3)、把干燥的氯气通入装有干燥苯的反应器C中制备氯苯,温度过高,苯挥发,由于苯易挥发,反应产生的HCl,且有未反应的氯气,都会在D出口导出;
(4)、氯化液水洗、碱洗出去杂质,加入无水CaCl2吸水干燥,过滤后的滤液蒸馏、精馏得到产品;
(5)、![]() ;
;
(6)、苯气相氧氯化氢法制氯苯:空气、氯化氢气混合物温度210°C,进入氯化反应器,在迪肯型催化剂(CuCl2、FeCl3附在三氧化铝上)存在下进行氯化生成氯苯和水。
(1)、A反应器是利用实验室法制取氯气,反应原理为: MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,玻璃管B伸入液面下,装置内压强过大时,可以用于平衡气压;
MnCl2+Cl2↑+2H2O,玻璃管B伸入液面下,装置内压强过大时,可以用于平衡气压;
故答案为:平衡气压;
(2)、根据氯气、苯、铁屑作为反应物书写方程式为: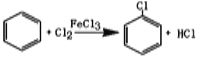 ;
;
(3)、把干燥的氯气通入装有干燥苯的反应器C中制备氯苯,C的反应温度不宜过高,原因为①温度过高,反应得到二氯苯;②温度过高,苯挥发,原料利用率不高,由于苯易挥发,反应产生的HCl,且有未反应的氯气,D出口气体中含有HCl、苯蒸汽、氯气;
(4)、氯化钙易吸水,净化过程中加入无水CaCl2的目的是吸水干燥,故答案为:吸水干燥;
(5)、在C三口烧瓶中加入50.0mL苯(含催化剂FeCl3),密度0.88g/mL,苯的质量近似0.88g/mL×50mL=44g,反应理论上生成一氯苯质量=![]() ,实验中最终得到产品22.5mL为一氯苯,其质量=1.1g/mL×22.5mL=24.75g,产率
,实验中最终得到产品22.5mL为一氯苯,其质量=1.1g/mL×22.5mL=24.75g,产率![]() ;
;
故答案:39%;
(6)、气相法制氯苯是将空气、氯化氢气体混合物与苯在温度为210℃,迪肯型催化剂(CuCl2、FeCl3附在三氧化铝上)存在下进行氯化,发生反应生成氯苯和水,反应的化学方程式为:2![]() + 2HCl + O2
+ 2HCl + O2![]() 2
2![]() +2H2O。
+2H2O。

【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实 验 步 骤 | 解 释 或 实 验 结 论 |
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空: (1)A的相对分子质量为:____。 |
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为:_______。 |
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团:___________。 |
(4)A的核磁共振氢谱如下图:
| (4)A中含有________种氢原子。 |
(5)综上所述,A的结构简式_____________。 | |