题目内容
15.我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2$\stackrel{催化剂}{→}$CO2+H2O.下列有关说法正确的是( )| A. | 该反应为放热反应 | B. | CO2分子中的化学键为非极性键 | ||
| C. | HCHO分子中只含δ键不含π键 | D. | 设生成1.8gH2O消耗2.24L O2 |
分析 A.大多数放热反应在常温下能进行;
B.二氧化碳中只存在C=O键;
C.一个单键为一个δ键,一个双键中含一个δ键,一个π键,HCHO中含2个C-H键和1个C=O键;
D.气体的体积与温度、压强有关,状况未知.
解答 解:A.大多数放热反应在常温下能进行,该反应为氧化反应常温下进行,则为放热反应,故A正确;
B.二氧化碳中只存在C=O键,为极性键,故B错误;
C.一个单键为一个δ键,一个双键中含一个δ键,一个π键,HCHO中含2个C-H键和1个C=O键,则含3个δ键、1个π键,故C错误;
D.气体的体积与温度、压强有关,状况未知,则不能计算氧气的体积,故D错误;
故选A.
点评 本题考查化学键,为高频考点,把握习题中的信息及共价键的形成、类型为解答的关键,侧重分析与应用能力的考查,注意放热反应的判断,题目难度不大.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
5.下列热化学方程式中△H的值能表示可燃物的燃烧热的是( )
| A. | 2H2(g)+2Cl2(g)=4HCl(g)△H=-369、2kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol | |
| C. | 2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| D. | CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol |
3.下列说法正确的是( )
| A. | Na与水反应时增大水的用量可加快反应速率 | |
| B. | Fe与硫酸反应制取H2时,选用浓硫酸可加快反应速率 | |
| C. | 两支试管中分别加入相同浓度的H2O2溶液,其中一支试管中加少量MnO2,两支试管中产生氧气的快慢相同 | |
| D. | Al在氧气中燃烧生成Al2O3,将铝片改成铝粉燃烧更剧烈 |
10.下列有关物质的性质和该性质的应用均正确的是( )
| A. | 氢氟酸具有强酸性,可用于蚀刻玻璃 | |
| B. | 碳具有还原性,一定条件下能将二氧化硅还原为硅 | |
| C. | BaCO3、BaSO4都难溶于水,可用作医疗上的钡餐 | |
| D. | 氧化铝具有很高的熔点,可用于制造熔融烧碱的坩埚 |
20.常温下、用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
| A. | $\frac{c(N{H}_{3}•{H}_{2}O)}{c(O{H}^{-})}$ | B. | $\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ | C. | c(H+)和c(OH-)的乘积 | D. | OH-的物质的量 |
7.美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意如图,下列说法正确的是( )
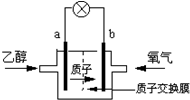

| A. | a极为电池的负极,乙醇被还原 | |
| B. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| C. | 电池正极的电极反应为:2H++O2+4e-=H2O | |
| D. | 电池工作时1mol乙醇被氧化时,就有12mol质子通过质子交换膜 |
4.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 生成物能量一定低于反应物总能量 | |
| B. | 放热反应不必加热就一定能发生 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应的焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H不同 |
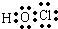
 .
.