题目内容
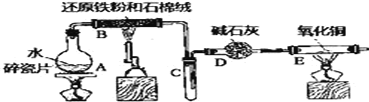
【题目】根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用如图装置进行实验,测定CN-被处理的百分率。

现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:甲中的反应_________________,乙中的反应:_____________________。
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是______________,丁装置的目的是________________________;干燥管Ⅱ的作用是______________________。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比_____(填“偏高”或“偏低”),简述可能的原因:______________________。
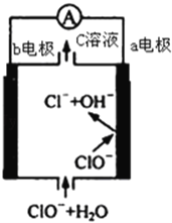
(4)含氰废水也可采用电化学方法进行处理。在碱性条件下,使用惰性电极电解含氰废水,氰离子被氧化为无毒的物质,其中阳极电极反应式是___________________。
【答案】CN-+ClO-![]() CNO-+Cl- 2CNO-+6ClO-+8H+=N2↑+2CO2↑+3Cl2↑+4H2O 浓硫酸 除去Cl2 防止空气中的CO2、水蒸气进入干燥管I,影响CO2的测量 偏低 前面装置中残留有CO2未被完全吸收 CN- +12OH--10e- =2CO32- +N2↑+6H2O
CNO-+Cl- 2CNO-+6ClO-+8H+=N2↑+2CO2↑+3Cl2↑+4H2O 浓硫酸 除去Cl2 防止空气中的CO2、水蒸气进入干燥管I,影响CO2的测量 偏低 前面装置中残留有CO2未被完全吸收 CN- +12OH--10e- =2CO32- +N2↑+6H2O
【解析】
利用干燥管I吸收二氧化碳,在吸收之前要处理水蒸气和氯气,用铜来处理氯气,用浓硫酸干燥,为了减少实验误差,干燥管II防止空气中二氧化碳和水蒸气进入干燥管I。据此分析解答。
(1)根据题意,甲中是CN-与ClO-在催化剂作用下反应生成CNO-和Cl-,因此甲中的反应CN-+ClO-![]() CNO-+Cl-,CNO-和Cl-在酸性条件下继续与NaClO反应生成N2、CO2和Cl2,因此乙中的反应:2CNO-+6ClO-+8H+ =N2↑+2CO2↑+3Cl2↑+4H2O;故答案为:CN-+ClO-
CNO-+Cl-,CNO-和Cl-在酸性条件下继续与NaClO反应生成N2、CO2和Cl2,因此乙中的反应:2CNO-+6ClO-+8H+ =N2↑+2CO2↑+3Cl2↑+4H2O;故答案为:CN-+ClO-![]() CNO-+Cl-;2CNO-+6ClO-+8H+ = N2↑+2CO2↑+3Cl2↑+4H2O。
CNO-+Cl-;2CNO-+6ClO-+8H+ = N2↑+2CO2↑+3Cl2↑+4H2O。
(2)利用干燥管I吸收二氧化碳,在吸收之前要处理水蒸气和氯气,用铜来处理氯气,用浓硫酸干燥,为了减少实验误差,干燥管II防止空气中二氧化碳和水蒸气进入干燥管I,因此丙装置中的试剂是浓硫酸,丁装置的目的是除去Cl2;干燥管Ⅱ的作用是防止空气中的CO2、水蒸气进入干燥管I,影响CO2的测量;故答案为:浓硫酸;除去Cl2;防止空气中的CO2、水蒸气进入干燥管I,影响CO2的测量。
(3)由于装置中反应生成的二氧化碳会留在装置中没有被吹出,未完全被干燥管I吸收,因此利用该装置测得的CN-被处理的百分率与实际值相比偏低;故答案为:偏低;前面装置中残留有CO2未被完全吸收。
(4)在碱性条件下,使用惰性电极电解含氰废水,氰离子被氧化为无毒的氮气和碳酸根离子,因此阳极电极反应式是CN- +12OH--10e- =2CO32- +N2↑+6H2O。

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。
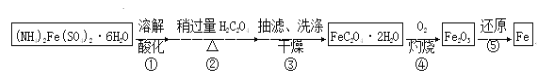
已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。
请回答:
(1)下列操作或描述正确的是________。
A.步骤②,H2C2O4稍过量主要是为了抑制Fe2+水解
B.步骤③,采用热水洗涤可提高除杂效果
C.步骤③,母液中的溶质主要是(NH4)2SO4和H2C2O4
D.步骤③,如果在常压下快速干燥,温度可选择略高于100℃
(2)如图装置,经过一系列操作完成步骤③中的抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):

开抽气泵→a→b→d→________→c→关抽气泵。
a.转移固液混合物;b.关活塞A;c.开活塞A;d.确认抽干;e.加洗涤剂洗涤
抽滤和普通过滤相比,优点是___________________________________________。
(3) 称取一定量的FeC2O4·2H2O试样,用硫酸溶解,
采用KMnO4滴定法测定,折算结果如下:
n(Fe2+)/mol | n( | 试样中FeC2O4·2H2O的质量分数 |
9.80×10ˉ4 | 9.80×10ˉ4 | 0.980 |
由表中数据推测试样中最主要的杂质是____________________。
(4)实现步骤④必须用到的两种仪器是____________________
(供选仪器:a.烧杯;b.坩埚;c.蒸馏烧瓶;d.高温炉;e.表面皿;f.锥形瓶);
该步骤的化学方程式是______________________________________。
(5)为实现步骤⑤,不宜用碳粉还原Fe2O3,理由是________________________________。