题目内容
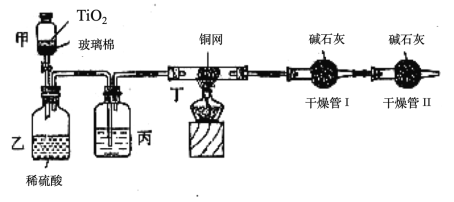
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示。
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,可向污水中加入适量的____________。
a.Na2SO4 b.H2SO4 c.NaOH d.CH3COOH e.NaCl
(2)除污过程中污水池中阳离子将移向____极(填:“正”或“负”或“阴”或“阳”)。
(3)电解池阳极发生了两个电极反应,电极反应式是
Ⅰ. Fe-2e-=Fe2+ Ⅱ.______________________________________。
(4)以上电解过程是以上图右侧的燃料电池为电源,该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。
①负极的电极反应是____________________________________________;
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环。A物质的电子式为__________。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)_________L。
【答案】ae 阴 4OH-- 4 e-= 2H2O+O2↑ CH4+4CO32--8e-=5CO2+2H2O ![]() 11.2
11.2
【解析】
利用燃料电池供电,电解无水从而达到净化水的目的。燃料电池中,通入燃料的一极是负极,即通入甲烷的一极是负极,通入空气的一极是正极,氧气在正极上得到电子,和正极相连的是电解池的阳极,即铁作阳极,失去电子生成Fe2+,同时水电离的氢氧根离子也会在阳极上失去电子生成氧气,可以把Fe2+氧化为氢氧化铁,Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极是水电离出来的氢离子得到电子生成氢气,可以把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用。
(1)为了增强溶液的导电性,且要保持污水的pH在5.0~6.0之间,因此加入的使导电能力增强的电解质必须是可溶于水的、显中性的盐,所以答案选ae。
(2)电解池中阳离子得到电子,向阴极移动。
(3)电解池中阳极失去电子,则另一个电极反应式应该是溶液中的OH-放电,即4OH-- 4 e-= 2H2O+O2↑。
(4)①燃料电池中,负极反应一定是燃料失去电子的过程,该电池的电解质是熔融碳酸盐,所以电极反应为CH4+4CO32--8e-=5CO2+2H2O。
②电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳。CO2是含有共价键的共价化合物,电子式是![]() 。
。
(5)阴极的电极反应为2H++2e-=H2↑,阴极产生了44.8L(标准状况)即2mol的氢气产生,所以转移电子的物质的量为4mol。根据电池的负极电极反应是CH4+4CO32--8e-=5CO2+2H2O可知,当转移4mol电子时,消耗CH4的物质的量是0.5mol,则在标准状况下的体积V=nVm=0.5mol×22.4L/mol=11.2L。

【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
【题目】苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应原理,可以进行苯甲酸甲酯的合成。有关物质的物理性质、实验装置如下所示:
苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
熔点/℃ | 122.4 | ﹣97 | ﹣12.3 |
沸点/℃ | 249 | 64.3 | 199.6 |
密度/g.cm﹣3 | 1.2659 | 0.792 | 1.0888 |
水溶性 | 微溶 | 互溶 | 不溶 |
实验一:制取苯甲酸甲酯
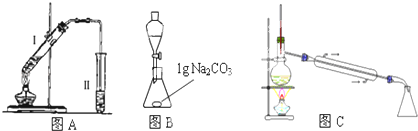
在大试管中加入15g苯甲酸和一定量的甲醇,边振荡边缓慢加入一定量浓硫酸,按图A连接仪器并实验。
(1)苯甲酸与甲醇反应的化学方程式为______________________________________。
(2)中学实验室中制取乙酸乙酯时为了提高酯的产率可以采取的措施有___________________________
实验二:提纯苯甲酸甲酯
该实验要先利用图B装置把图A中制备的苯甲酸甲酯水洗提纯,再利用图C装置进行蒸馏提纯
(3)用图B装置进行水洗提纯时,B装置中固体Na2CO3作用是__________________。
(4)用图C装置进行蒸馏提纯时,当温度计显示____________时,可用锥形瓶收集苯甲酸甲酯。
(5)最终制取15g苯甲酸甲酯,计算得苯甲酸甲酯的产率为______________(小数点后保留1位有效数字)。