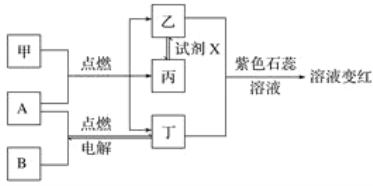
题目内容
【题目】向100ml 0.5mol/L AlCl3 中逐渐加入0.5mol/L的NaOH 溶液,最后得到白色沉淀2.65克。求用去的NaOH 溶液的体积___。
【答案】NaOH不足时,用去的NaOH溶液的体积为180mL,NaOH过量时,用去的NaOH溶液的体积为340mL
【解析】
根据AlCl3的物质的量和Al(OH)3沉淀的质量判断出AlCl3没有完全生成Al(OH)3沉淀,存在两种情况:NaOH不足;NaOH过量,部分生成NaAlO2,根据反应的化学方程式讨论计算。
n(AlCl3)=cV=100×103L×0.5molL1=0.05mol,沉淀的物质的量n=![]() =
=![]() =0.03mol,则AlCl3没有完全生成Al(OH)3沉淀,存在两种情况:
=0.03mol,则AlCl3没有完全生成Al(OH)3沉淀,存在两种情况:
(1)NaOH不足,
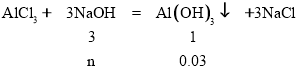
n=0.09mol,V(NaOH)=![]() =0.18L,即180mL;
=0.18L,即180mL;
(2)NaOH过量,部分Al(OH)3与NaOH反应生成NaAlO2,被消耗的沉淀物质的量=0.05-0.03mol=0.02mol,
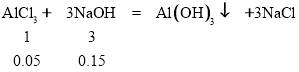
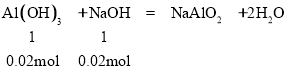
共需n(NaOH)=0.15mol+0.02mol=0.17mol,
V(NaOH)=![]() =
=![]() =0.34L,即340mL,
=0.34L,即340mL,
故NaOH不足时,用去的NaOH溶液的体积为180mL,NaOH过量时,用去的NaOH溶液的体积为340mL。

 53随堂测系列答案
53随堂测系列答案【题目】某研究小组在电压为24V时进行如下实验,电解3分钟后,发现下列现象。
编号 | ① | ② | ③ |
装置 |
|
|
|
现象 | 小灯泡微弱发光,两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 | 两极均产生气泡,溶液无明显变化 | 两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 |
下列说法正确的是( )
A.①中小灯泡微亮是因为Ca(OH)2是弱电解质
B.对比①和②,白色浑浊的出现与电极材料无关
C.对比①和③,白色浑浊是由于OH-迁移到阳极使Ca(OH)2沉淀析出
D.阳极附近白色沉淀的成分可能是CaCO3