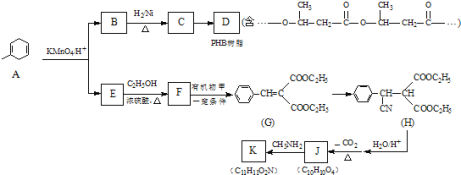
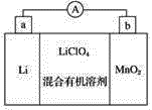
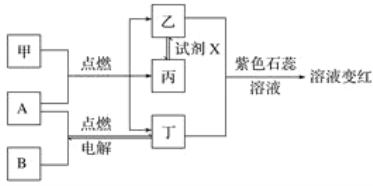
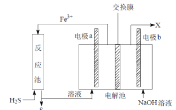
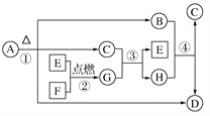
��Ŀ����
����Ŀ��CO2�����������壬Ҳ����Ҫ�Ļ���ԭ�ϣ���CO2Ϊԭ�Ͽɺϳɶ����л��
��1��CO2����������ϩ����֪��2CO2��g��+6H2��g��![]() CH2=CH2��g��+4H2O��g�� ��H=QkJ/mol��һ�������£�����ͬ��Ͷ�ϱ�X[X=
CH2=CH2��g��+4H2O��g�� ��H=QkJ/mol��һ�������£�����ͬ��Ͷ�ϱ�X[X=![]() ]��ij�ݻ��ɱ�ĺ�ѹ�ܱ������г���CO2��H2����ò�ͬͶ�ϱ�ʱCO2��ת�������¶ȵĹ�ϵ��ͼ��ʾ��
]��ij�ݻ��ɱ�ĺ�ѹ�ܱ������г���CO2��H2����ò�ͬͶ�ϱ�ʱCO2��ת�������¶ȵĹ�ϵ��ͼ��ʾ��
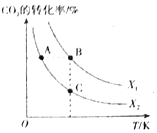
��X1___X2����������������������ͬ����Q___0��
��ͼ��A��B��C�����Ӧ��ƽ�ⳣ��KA��KB��KC�Ĵ�С��ϵΪ___��
��2�������£���NaOH��Һ��CO2�����������Խ���̼�ŷţ����ҿɵõ���Ҫ�Ļ�����ƷNa2CO3��
����ij�β���õ�pH=10����Һ������Һ��c��CO![]() ����c��HCO
����c��HCO![]() ��=___[������K1��H2CO3��=4.4��10-7��K2��H2CO3��=5��10-11]��
��=___[������K1��H2CO3��=4.4��10-7��K2��H2CO3��=5��10-11]��
������5LNa2CO3��Һ��23.3gBaSO4����ȫ��ת��ΪBaCO3�������õ�Na2CO3��Һ�����ʵ���Ũ������Ϊ___��[��֪��������Ksp��BaSO4��=1��10-7��Ksp��BaCO3��=2.5��10-6].��������Һ������ı仯��
���𰸡��� �� KA��KB=KC 1��2 0.52mol/L
��������
�����¶ȶ�ƽ���Ӱ�죬��ѧƽ�ⳣ��ֻ���¶�Ӱ�죻���ݵ���ƽ�ⳣ�����ܽ�ƽ�ⳣ����ʽ���㼴�ɡ�
��1������ͬ�����£�����������Ũ�ȣ�CO2��ת��������X1��X2����ͼ��֪���¶����ߺ�CO2��ת���ʽ��ͣ�˵��ƽ�����淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ��Q��0��
�ڻ�ѧƽ�ⳣ�����¶��йأ��¶���ȣ�K��ȣ���ӦΪ���ȷ�Ӧ���¶Ƚϵ�ʱK�ϴ�KA��KB��KC��
��2������ij�β���õ�pH��10����Һ��c��H+����10-10mol/L��K2=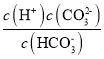 ������Һ��c��
������Һ��c��![]() ����c��
����c��![]() ����K2��c��H+����(5��10-11):(10-10)=1:2��
����K2��c��H+����(5��10-11):(10-10)=1:2��
��23.3gBaSO4���ʵ���n��BaSO4����![]() ��0.1mol����0.1mol���ᱵ�ܽ���5L��Һ�У���������Ҫ���ʵ���Ũ��Ϊxmol/L��Na2CO3��Һ����BaSO4��ȫ�ܽ������5L��Һ��c��
��0.1mol����0.1mol���ᱵ�ܽ���5L��Һ�У���������Ҫ���ʵ���Ũ��Ϊxmol/L��Na2CO3��Һ����BaSO4��ȫ�ܽ������5L��Һ��c��![]() ��=0.02mol/L����ʱ��Һ��c��
��=0.02mol/L����ʱ��Һ��c��![]() ��=��x-0.02��mol/L����BaSO4+
��=��x-0.02��mol/L����BaSO4+![]() BaCO3+
BaCO3+![]() ��֪���˷�Ӧ�Ļ�ѧƽ�ⳣ��K=
��֪���˷�Ӧ�Ļ�ѧƽ�ⳣ��K= 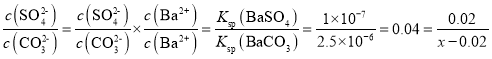 �����x=0.52��
�����x=0.52��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�