题目内容
无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另外一种固体.某学生将无水亚硫酸钠受热后的试样溶于水制成浓溶液,用下图所示的实验装置进行实验,他向试样溶液中缓缓地逐滴加入足量稀盐酸,试根据实验现象判断固体试样含有什么成分.
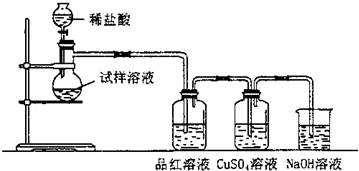
(1)无水亚硫酸钠受热分解的化学方程式是 ,装置中的NaOH溶液的作用是 .
(2)若观察到试样溶液中出现淡黄色浑浊,品红溶液中有气泡生成但不褪色,CuSO4溶液中出现黑色沉淀,则试样溶液中发生反应的离子方程式是 ;导致品红有气泡不褪色的原因是: .
(3)若观察到品红溶液和CuSO4溶液中均无明显的现象发生,原因是 .

(1)无水亚硫酸钠受热分解的化学方程式是
(2)若观察到试样溶液中出现淡黄色浑浊,品红溶液中有气泡生成但不褪色,CuSO4溶液中出现黑色沉淀,则试样溶液中发生反应的离子方程式是
(3)若观察到品红溶液和CuSO4溶液中均无明显的现象发生,原因是
考点:性质实验方案的设计
专题:实验设计题
分析:(1)根据题示信息可推出分解产物是Na2SO4;无水亚硫酸钠受热分解会产生SO2、H2S等气体;
(2)SO32-、S2-可在酸性条件下转化为单质硫;品红溶液不裉色,则发生SO32-+2S2-+6H+=3S↓+3H2O后硫化钠过量;
(3)品红溶液和硫酸铜溶液中都没有明显现象,说明在烧瓶中没有放出SO2,也没有放出H2S.
(2)SO32-、S2-可在酸性条件下转化为单质硫;品红溶液不裉色,则发生SO32-+2S2-+6H+=3S↓+3H2O后硫化钠过量;
(3)品红溶液和硫酸铜溶液中都没有明显现象,说明在烧瓶中没有放出SO2,也没有放出H2S.
解答:
解:(1)亚硫酸钠在600℃以上可分解,由题示信息可知,“Na2SO3分解生成Na2S+另一种固体”,为氧化还原反应,生成硫化钠时S元素的化合价降低,则另一种固体中硫元素的化合价应高于+4价,所以这种固体是Na2SO4,反应的化学方程式是4Na2SO3
Na2S+3Na2SO4;从中可得出,装置中会产生SO2、H2S等气体,考虑到这些气体都不能直接排放到空气中,所以氢氧化钠溶液的作用是吸收SO2或H2S,
故答案为:4Na2SO3
Na2S+3Na2SO4;吸收H2S或SO2气体;
(2)温度高于600℃时,Na2SO3开始分解,所得固体可能是Na2SO3、Na2S等的混合物.滴入稀盐酸时,SO32-、S2-可在酸性条件下转化为单质硫,根据“硫酸铜中出现黑色沉淀”可得出,烧瓶中没有SO2放出,试样溶液出现的现象是:有淡黄色沉淀生成并有气泡冒出,沉淀为S、气体为硫化氢,则试样溶液中发生反应的离子方程式为SO32-+2S2-+6H+=3S↓+3H2O,S2-+2H+=H2S↑;品红溶液不裉色,是因为加热后的固体试样中所含亚硫酸钠和硫化钠的物质的量之比小于1:2,在酸性溶液中反应,Na2S过量,产生气体只含H2S,不含SO2,
故答案为:SO32-+2S2-+6H+=3S↓+3H2O,S2-+2H+=H2S↑;加热后固体中所含的Na2SO3和Na2S的物质的量之比小于1:2,在酸性溶液中反应产生的气体只含H2S,而不含SO2;
(3)品红溶液和硫酸铜溶液中都没有明显现象,说明在烧瓶中没有放出SO2,也没有放出H2S,进而可推出,加热后的固体试样中所含亚硫酸钠和硫化钠的物质的量之比恰好等于1:2,在酸性溶液中两者恰好完全反应,不产生H2S和SO2,
故答案为:加热后固体中所含Na2SO3和Na2S的物质的量之比等于1:2,在酸性溶液中恰好生成S,不产生H2S和SO2.
| ||
故答案为:4Na2SO3
| ||
(2)温度高于600℃时,Na2SO3开始分解,所得固体可能是Na2SO3、Na2S等的混合物.滴入稀盐酸时,SO32-、S2-可在酸性条件下转化为单质硫,根据“硫酸铜中出现黑色沉淀”可得出,烧瓶中没有SO2放出,试样溶液出现的现象是:有淡黄色沉淀生成并有气泡冒出,沉淀为S、气体为硫化氢,则试样溶液中发生反应的离子方程式为SO32-+2S2-+6H+=3S↓+3H2O,S2-+2H+=H2S↑;品红溶液不裉色,是因为加热后的固体试样中所含亚硫酸钠和硫化钠的物质的量之比小于1:2,在酸性溶液中反应,Na2S过量,产生气体只含H2S,不含SO2,
故答案为:SO32-+2S2-+6H+=3S↓+3H2O,S2-+2H+=H2S↑;加热后固体中所含的Na2SO3和Na2S的物质的量之比小于1:2,在酸性溶液中反应产生的气体只含H2S,而不含SO2;
(3)品红溶液和硫酸铜溶液中都没有明显现象,说明在烧瓶中没有放出SO2,也没有放出H2S,进而可推出,加热后的固体试样中所含亚硫酸钠和硫化钠的物质的量之比恰好等于1:2,在酸性溶液中两者恰好完全反应,不产生H2S和SO2,
故答案为:加热后固体中所含Na2SO3和Na2S的物质的量之比等于1:2,在酸性溶液中恰好生成S,不产生H2S和SO2.
点评:本题考查性质实验方案的设计,涉及定性与定量实验,注意实验现象的分析推测、实验结果的研究处理等都会涉及到定量问题,同一实验在不同条件下可能会产生不同的结果,侧重分析与实验能力的综合考查,题目难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式表达不正确的是( )
| A、小苏打溶液跟烧碱溶液反应:HCO3-+OH-═CO32-+H2O |
| B、氢氧化钡溶液中通入少二氧化硫的反应:SO2+OH-═HSO3- |
| C、三氯化铁溶液跟过量氨水反应:Fe3++3NH3?H2O═Fe(OH)3↓+3NH4+ |
| D、氢氧化铝与氢氧化钠溶液反应:Al(OH)3+OH-═AlO2-+2H2O |
1L的密闭容器中有0.3mol A、0.1mol C和一定量B三种气体.一定条件下发生反应,各物质浓度随时间变化如图甲所示,t1时刻c(B)=0.1mol/L.图乙为t2时刻后改变条件反应速率随时间的变化情况,每次改变一种条件且条件各不相同,已知,t3时刻为加入催化剂,则下列判断正确的是( )
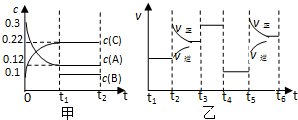

| A、t4时刻是增大容器的体积 |
| B、B的起始浓度为0.06mol/L |
| C、t1、t3、t6时刻相比,A物质的量最大的是t6时刻 |
| D、该可逆反应的方程式为:3A(g)?B(g)+2C(g) |
下列与有机物的结构、性质、用途有关的叙述,不正确的是( )
| A、乙醇、乙酸、乙酸乙酯都能发生取代反应 |
| B、乙酸乙酯、油脂与NaOH溶液反应均有醇生成 |
| C、乙烯和聚乙烯中均含有不饱和碳碳双键 |
| D、淀粉和蛋白质都是高分子化合物 |
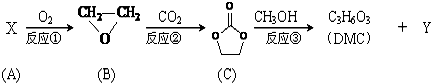
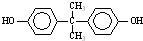 )在一定条件下发生缩聚反应,可生成芳香族聚碳酸酯,写出反应的化学方程式
)在一定条件下发生缩聚反应,可生成芳香族聚碳酸酯,写出反应的化学方程式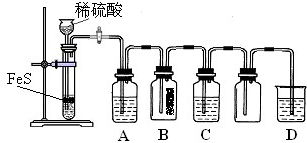
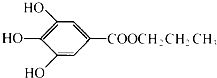 没食子酸丙酯简称PG,是一种白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.其结构简式如图所示.已知:PG经水解可转化为没食子酸,没食子酸能与NaHCO3溶液反应生成CO2
没食子酸丙酯简称PG,是一种白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.其结构简式如图所示.已知:PG经水解可转化为没食子酸,没食子酸能与NaHCO3溶液反应生成CO2
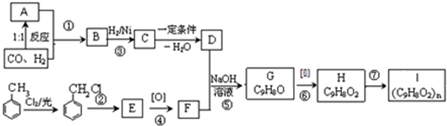
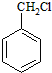 为主要原料合成
为主要原料合成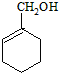 ,请设计四步合成路线(无机试剂及溶剂任选).
,请设计四步合成路线(无机试剂及溶剂任选).