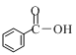
题目内容
【题目】(1)如图是一个化学过程的示意图。
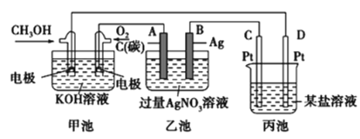
①乙池中总反应的离子方程式____________。
②电解一段时间后,向乙池的溶液中加入________________可恢复为原溶液。
③当乙池中B(Ag)极的质量增加5.40g,此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是________。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
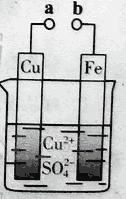
(2)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:

①写出负极的电极反应式:___________。
②图中X溶液是________。
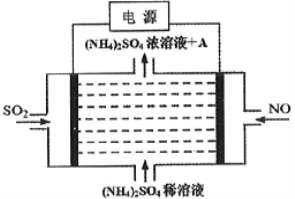
③利用图中设计的原电池为电源可将雾霾中的NO、SO2电解分别转化为NH4+和SO42-,如图所示,则物质A的化学式为_____________,阴极的电极反应式为______________。
【答案】4Ag++2H2O![]() 4Ag+O2↑+4H+ Ag2O BD Cu-2e-=Cu2+ FeCl3溶液 H2SO4 NO+5e-+6H+=NH4++H2O
4Ag+O2↑+4H+ Ag2O BD Cu-2e-=Cu2+ FeCl3溶液 H2SO4 NO+5e-+6H+=NH4++H2O
【解析】
(1)甲池为甲醇燃料电池,通入甲醇的一极为负极,通入氧气的为正极;乙池为电解池,A与燃料电池的正极相连,为阳极,B为阴极;丙为电解池,D与燃料电池的负极相连,为阴极,C为阳极;
(2)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成原电池,Cu元素化合价升高,为负极,Fe元素化合价降低,FeCl3在正极反应,X溶液为FeCl3溶液。
(1)①乙池为电解池,A为阳极,水失电子生成O2和H+,B为阴极,Ag+得电子生成Ag,总反应为:4Ag++2H2O![]() 4Ag+O2↑+4H+,故答案为:4Ag++2H2O
4Ag+O2↑+4H+,故答案为:4Ag++2H2O![]() 4Ag+O2↑+4H+;
4Ag+O2↑+4H+;
②从总反应来看,电解过程Ag原子和O原子按2:1以Ag和O2的形式析出了,所以,加一定量的Ag2O能恢复为原溶液,故答案为:Ag2O;
③乙池中B(Ag)极的电极反应式为:Ag++e-=Ag,当Ag极增加5.4g,即n(Ag)=![]() =0.05mol时,由Ag++e-=Ag可知,通过电路中的电子的物质的量n(e-)=0.05mol。丙池为电解池,阴极表面析出金属,该金属的阳离子的放电顺序要在水电离的H+前面,否则不会析出金属。要生成1.6g固体,则生成1.6g固体转移的电子的物质的量必须小于等于0.05mol(生成1.6g固体后,若金属离子已反应完,H2O电离的H+继续得电子即可)。
=0.05mol时,由Ag++e-=Ag可知,通过电路中的电子的物质的量n(e-)=0.05mol。丙池为电解池,阴极表面析出金属,该金属的阳离子的放电顺序要在水电离的H+前面,否则不会析出金属。要生成1.6g固体,则生成1.6g固体转移的电子的物质的量必须小于等于0.05mol(生成1.6g固体后,若金属离子已反应完,H2O电离的H+继续得电子即可)。
A.Mg2+的放电顺序在H+之后,不会析出金属Mg,A错误;
B.Cu2+的放电顺序在H+之前,Cu2++2e-=Cu,则析出Cu的质量=1.6g,则通过电路的电子的物质的量n(e-)=0.05mol,符合题意,B正确;
C.Na+的放电顺序在H+之后,不会析出金属Na,C错误;
D.Ag+的放电顺序在H+之前,Ag++e-=Ag,析出1.6g固体(Ag)时,即n(Ag)=![]() =
=![]() ,则通过电路的电子的物质的量n(e-)=n(Ag)=
,则通过电路的电子的物质的量n(e-)=n(Ag)=![]() ≈0.0148mol<0.05mol,符合题意,D正确;
≈0.0148mol<0.05mol,符合题意,D正确;
故答案为:BD;
(2)①Cu失电子,化合价升高,作负极,电极反应式为:Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+;
②Cu作负极,则C作正极,FeCl3在正极得电子生成FeCl2,则X溶液为FeCl3溶液,故答案为:FeCl3溶液;
③NO得电子,转化为NH4+,则电解池右边电极为阴极,电极反应式为:NO+5e-+6H+=NH4++H2O,SO2失电子,转化为SO42-,左边电极为阳极,电极反应式为:SO2-2e-+2H2O=SO42-+4H+,总反应为:![]() ,所以,物质A为H2SO4,故答案为:H2SO4;NO+5e-+6H+=NH4++H2
,所以,物质A为H2SO4,故答案为:H2SO4;NO+5e-+6H+=NH4++H2