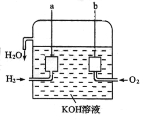
题目内容
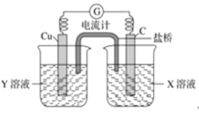
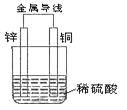
【题目】锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是

A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.产生气泡的速度甲比乙慢
D.两烧杯中溶液的 H+的浓度均减小
【答案】D
【解析】
甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑;乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,据此分析解答。
A.甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;
B.甲中铜为正极,乙中不构成原电池,铜片不是电极,故B错误;
C.甲能形成原电池,乙不能构成原电池,所以产生气泡的速度甲比乙快,故C错误;
D.甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,故D正确;
故选D。

【题目】α氯乙基苯是一种重要的有机合成中间体,其一种制备反应原理为![]() +Cl2(g)
+Cl2(g)![]() +HCl(g) ΔH
+HCl(g) ΔH
在T1℃时,向2.0 L恒容密闭容器中充入0.40 mol乙苯(g)和0.40 mol Cl2(g)进行反应,反应过程中测定的部分数据见下表:
t/min | 0 | 1 | 2 | 5 | 10 |
n(HCl)/mol | 0 | 0.12 | 0.20 | 0.32 | 0.32 |
下列有关说法正确的是 ( )
A.T1℃时,反应在0~2min内的平均速率v(α-氯乙基苯)=0.05mol·L-1·s-1
B.10min后,若保持其他条件不变,升高温度至T2℃,达到新平衡时测得c(α-氯乙基苯)=0.18mol·L-1,则反应的ΔH>0
C.温度从T1℃升至T2℃时,正向反应速率增大,逆向反应速率减小
D.T1℃时,体系的总压不变时,反应达到平衡状态