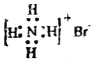题目内容
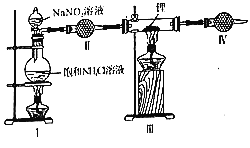
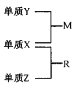
【题目】关于原电池装置Ⅰ若把盐桥(含氯化钾的琼胶)换成粗铜丝,左侧电解质溶液换成硫酸铜溶液,如图Ⅱ所示,两装置均工作一段时间(假设电极材料和电解质溶液均充足,且忽略能量损耗),关于以上两装置说法正确的是( )

A.两装置中锌(a)、锌 (c)两电极均发生氧化反应
B.当装置Ⅰ池铜(b)电极增重64g时,盐桥中转移2mol电子
C.取出Ⅱ装置中粗铜丝小心洗涤干燥称重比原铜丝质量轻
D.I池右侧硫酸铜溶液浓度几乎不变
【答案】A
【解析】
装置Ⅰ中Zn为负极,电极反应Zn﹣2e-=Zn2+,Cu做正极,电极反应Cu2++2e-=Cu,原电池装置Ⅰ若把盐桥(含氯化钾的琼胶)换成粗铜丝,左侧电解质溶液换成硫酸铜溶液,Ⅱ中左侧为原电池,Zn为负极,电极反应Zn﹣2e-=Zn2+,Cu做正极,电极反应Cu2++2e-=Cu,右侧为电解池,与锌连接的铜电极为阴极,电极反应:Cu2++2e-=Cu,粗铜丝做阳极,据此分析判断。
A.两装置中锌(a)、锌(c)做原电池负极,两电极均发生氧化反应,故A正确;
B.当装置Ⅰ池铜(b)电极增重64g时,物质的量为1mol,电极反应Cu2++2e-=Cu,盐桥中无电子转移,是盐桥中离子的定向移动,故B错误;
C.Ⅱ装置中左侧粗铜丝作正极,电极反应为:Cu2++2e-=Cu,右侧为电解池,粗铜丝作阳极,粗铜中的铁、锌等先放电,以此无法确定最终铜丝的质量如何变化,故C错误;
D.I池右侧,Cu做正极,电极反应Cu2++2e-=Cu,硫酸铜溶液浓度减小,故D错误;
故选:A。

 名校课堂系列答案
名校课堂系列答案【题目】利用铜萃取剂M,通过如下反应实现铜离子的富集:

(1)X难溶于水、易溶于有机溶剂,其晶体类型为________。
(2)M所含元素的电负性由大到小顺序为_______,N原子以_____轨道与O原子形成σ键。
(3)上述反应中断裂和生成的化学键有______(填序号)。
a.离子键
b.配位键
c.金属键
d.范德华力
e.共价键
(4)M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是_____。

(5)基态Cu2+的外围电子排布式为________,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。判断Sc3+、Zn2+的水合离子为无色的依据是___________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |