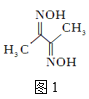
题目内容
【题目】【物质结构与性质,1 3分】
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式______________。
(2)下图曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系。其中A点表示的单质是________(填化学式)。

(3)三氟化硼分子的空间构型是__________;三溴化硼、三氯化硼分子结构与三氟化硼相似,如果把B—X键都当作单键考虑来计算键长,理论值与实测键长结果如下表。硼卤键长实测值比计算值要短得多,可能的原因是____________________________________________。

(4)CuCl的盐酸溶液能吸收CO生成复合物氯化羰基亚铜【Cu2C12(CO)2·2H20】,其结构如图。

①该复合物中Cl原子的杂化类型为_______________。
②该复合物中的配位体有________________种。
(5)已知HF与Fˉ通过氢键结合成![]() 。判断
。判断![]() 和
和![]() 微粒间能否形成氢键,并说明理由。____________________________________。
微粒间能否形成氢键,并说明理由。____________________________________。
【答案】(1)1s22s22p63s23p63d54s1;
(2)F2;
(3)平面正三角形;B与X原子之间还形成了π键;
(4)sp3;3
(5)在HF(F-H…F-)中,已经存在分子内氢键,所以没有可用于形成氢键的氢原子。
【解析】
试题(1)Cu的最外层电子数是1,属于第四周期元素,则第四周期元素中最外层电子数是1的过渡元素是Cr,核外电子排布式为1s22s22p63s23p63d54s1;
(2)根据图像可知,A点对应单质的沸点低于0℃,一般来说,气体的沸点低于0℃,随着原子序数的递增,连续的有四种元素的单质为气体,短周期内连续为气体的元素是N、O、F、Ne元素,则单质A应为F2。
(3)三氟化硼分子中硼原子的最外层价电子对数是3+1/2(3-3)=3,无孤对电子,所以三氟化硼分子的空间构型是平面正三角形;硼卤键长实测值比计算值要短得多,可能的原因是在B原子上有一个空的2p轨道,从三个卤素原子上的任何一个已经充满电子的对称性相同的p轨道接受一对电子形成了π键。
(4)①该复合物中Cl原子周围形成4个共价单键,所以Cl原子的杂化方式是sp3杂化;
②该配合物中,与亚铜离子形成配位键的都是该配合物的配体,有CO、Cl-、H2O3种;
(5)在HF(F-H…F-)中,已经存在分子内氢键,所以没有可用于形成氢键的氢原子。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案【题目】钼及其合金在冶金、电器等方面有广泛应用。在1L恒容密闭容器中充入足量的Na2CO3、MoS2和H2,发生反应:MoS2(s)+2Na2CO3(s)+4H2(g)Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H,测得在不同温度下H2的物质的量与时间关系数据如表所示:下列说法错误的是( )
min mol K | 0 | 10 | 20 | 30 | 40 |
T1 | 2 | 1.6 | 1.3 | 1.0 | 1.0 |
T2 | 2 | 1.2 | 1.0 | n | 0.6 |
A.T2>T1,△H<0
B.表格中n=0.6
C.T2K下20min时,v正>v逆
D.T1K下平衡常数K=0.25(molL-1)2