题目内容
【题目】一氯化硫(S2Cl2)是一种重要的有机合成氯化剂,实验室和工业上都可以用纯净干燥的氯气与二硫化碳反应来制取(CS2+3Cl2![]() CCl4+S2Cl2),其装置如下:
CCl4+S2Cl2),其装置如下:
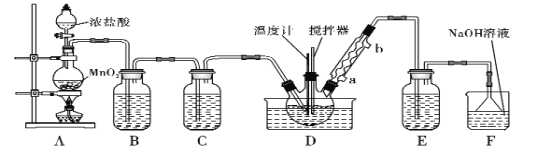
(1)A装置中的离子反应方程式为______________。
(2) 一氯化硫(S2Cl2)常温下较为稳定,受热易分解,易被氧化,且遇水即歧化,歧化产物中不仅有淡黄色固体,而且还有两种气体,用NaOH溶液吸收该气体可得两种盐Na2SO3和NaCl。 写出一氯化硫与水反应的化学反应方程式______________。
(3)B装置的作用是___________________________________。
(4)D中冷凝管的冷水进水口为____(填“a”或“b”);实验过程中,需要先点燃A处酒精灯,通入氯气一段时间后方可向D中水槽里面加入热水加热,这样做的目的是______________。
(5)F装置是用来处理尾气氯气的,已知该吸收反应的氧化产物不仅有NaClO还有NaClO3,且n(NaClO)/n(NaClO3)=3/1,则该反应被还原的氯原子与被氧化的氯原子物质的量之比为_____。
【答案】MnO2+ 2Cl-+4H+ ![]() Mn2++ Cl2↑+2H2O 2S2Cl2+2H2O = 3S↓+SO2↑+4HCl↑ 除去氯气中的HCl a 赶走装置内部的氧气和水,避免S2Cl2因反应而消耗 2:1
Mn2++ Cl2↑+2H2O 2S2Cl2+2H2O = 3S↓+SO2↑+4HCl↑ 除去氯气中的HCl a 赶走装置内部的氧气和水,避免S2Cl2因反应而消耗 2:1
【解析】
从装置图中可以看出,A为氯气的制取装置,B为除去氯气中氯化氢的装置,C为干燥氯气的装置,D为制取一氯化硫的装置,E为收集一氯化硫的装置,F为尾气处理装置。
(1)A装置实验室制取Cl2的装置,发生反应的离子反应方程式为MnO2+ 2Cl-+4H+ ![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
答案为:MnO2+ 2Cl-+4H+ ![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2) 一氯化硫(S2Cl2)常温下较为稳定,受热易分解,易被氧化,且遇水即歧化,歧化产物中不仅有淡黄色固体(S),而且还有两种气体(SO2、HCl),用NaOH溶液吸收该气体可得两种盐Na2SO3和NaCl。 一氯化硫与水反应的化学反应方程式2S2Cl2+2H2O = 3S↓+SO2↑+4HCl↑。
答案为:2S2Cl2+2H2O = 3S↓+SO2↑+4HCl↑
(3)B装置的作用是除去氯气中的HCl。答案为:除去氯气中的HCl
(4)冷凝管的冷却水流向都是下进上出。所以D中冷水进水口为a。答案为:a
因为一氯化硫易被氧化,且遇水即歧化,所以实验过程中,需要先点燃A处酒精灯,通入氯气一段时间后方可向D中水槽里面加入热水加热,这样做的目的是赶走装置内部的氧气和水,避免S2Cl2因反应而消耗。
答案为:赶走装置内部的氧气和水,避免S2Cl2因反应而消耗
(5)F装置是用来处理尾气氯气的,已知该吸收反应的氧化产物不仅有NaClO还有NaClO3,且n(NaClO)/n(NaClO3)=3/1,发生反应的化学方程式为:
6Cl2+12NaOH= 8NaCl+3NaClO+NaClO3+6H2O (按得失电子守恒配NaCl的化学计量数)
则该反应被还原的氯原子与被氧化的氯原子物质的量之比为8:(3+1)=2:1。
答案为2:1

【题目】下表所列各组物质中,物质之间通过一步反应不能实砚如下图所示转化的是
选项 | X | Y | Z |
A | Na | NaOH | NaCl |
B | Si | SiO2 | Na2SiO3 |
C | Cl2 | HClO | NaClO |
D | NO | NO2 | HNO3 |

A. A B. B C. C D. D
【题目】下表为九种主族元素在周期表中的位置:
A | |||||||
E | F | ||||||
B | D | I | G | ||||
C | H | ||||||
请回答下列问题:
(1)I元素的位置是第________周期,第______族。
(2)C、B、D 三种元素的金属性由强到弱的顺序为_______(填元素符号)。
(3)E、F两种元素对应的最简单氢化物的稳定性:________________ (填化学式)。
(4)C的单质与水反应的离子方程式为_______。
(5)用电子式表示A和G形成化合物的过程:____。