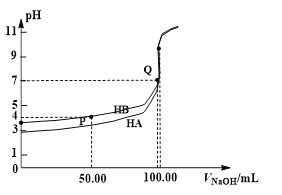
题目内容
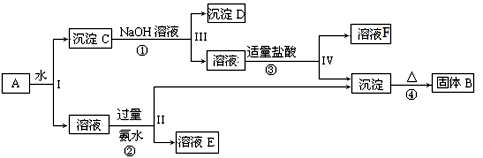
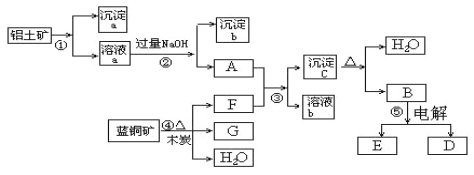
【题目】明矾[ KAl(SO4)2·12H2O ]在造纸、净水等方面应用广泛。以处理过的废旧易拉罐碎屑为原料(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。

回答下列问题:
(1)原料溶解过程中反应的离子方程式是_________________________。
(2)Al(OH)3 与稀硫酸反应的离子方程式是__________________________。
(3)溶液A中通入过量CO2,反应的离子方程式是_________________。
(4)为证明固体B中含有铁,某同学做如下实验:取少量固体B,加入稀硫酸使其溶解,观察到有无色气体生成。向溶液中加入___________,溶液立即变红,证明固体B中含有铁。
【答案】2Al+ 2OH- +2H2O= 2AlO2- +3H2↑ Al(OH)3 + 3H+ = Al3+ +3H2O AlO2- +CO2+2H2O =Al(OH)3 ↓+ HCO3- KSCN溶液和少量氯水
【解析】
废旧易拉罐碎屑主要成分为Al,含有少量的Fe、Mg杂质,铝与热氢氧化钠溶液反应生成偏铝酸钠和氢气,过滤后得到溶液A为偏铝酸钠溶液,固体B为Fe、Mg混合物;溶液A中通入过量二氧化碳后生成氢氧化铝沉淀和碳酸氢钠,通过过滤得到碳酸氢钠溶液(溶液C)和氢氧化铝(固体D);固体D[Al(OH)3]与稀硫酸反应生成硫酸铝,硫酸铝与硫酸钾混合溶液,加热蒸发浓缩、冷却结晶、过滤洗涤,可以得到明矾[KAl(SO4)212H2O],据此进行解答。
(1)废旧易拉罐碎屑的主要成分为Al,含有少量的Fe、Mg杂质,加入热氢氧化钠溶液,铝反应生成偏铝酸钠和氢气,反应方程式是2Al +2OH-+2H2O=2AlO2- +3H2↑;
(2)氢氧化铝是难溶性的两性氢氧化物,与硫酸反应产生硫酸铝和水,反应的离子方程式是 Al(OH)3+3H+ =Al3+ +3H2O;
(3)溶液A为偏铝酸钠溶液,由于酸性H2CO3> Al(OH)3,所以向溶液A中通入过量CO2气体,反应生成氢氧化铝沉淀和碳酸氢钠,方程式是:AlO2- +CO2+2H2O = Al(OH)3 ↓+ HCO3-;
(4)固体B是Fe、Mg混合物,为证明其中含有Fe,可取少量固体B,加入稀硫酸使其溶解,观察到有无色气体生成,Fe与稀硫酸反应生成硫酸亚铁和氢气,向该溶液中滴加KSCN溶液后不变色,再加入几滴氯水,溶液立即变红,证明固体B与硫酸反应后溶液中含有Fe2+,则固体B中含有铁,所以所价试剂为KSCN溶液、氯水。

【题目】苯甲酸具有弱酸性,可以和乙醇发生酯化反应生成苯甲酸乙酯。苯甲酸乙酯(密度1.05 g·cm-3)稍有水果气味,用于配制香水香精和人造精油,也大量用于食品以及用作有机合成中间体等。制备苯甲酸乙酯的过程如下:
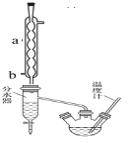
(1)制备粗产品:如图所示装置中,于50 mL圆底烧瓶中加入8.0 g苯甲酸(Mr=122)、20 mL乙醇(Mr=46,密度0.79 g·cm-3)、15 mL环己烷、3 mL浓硫酸,摇匀,加沸石。在分水器中加水,接通冷凝水,水浴回流约2 h,反应基本完成。记录体积,继续蒸出多余环己烷和醇(从分水器中放出)。
(2)粗产品纯化:加水30 mL,分批加入固体NaHCO3,分液,然后水层用20 mL石油醚分两次萃取。合并有机层,用无水硫酸镁干燥。回收石油醚,加热精馏,收集210~213 ℃馏分。
相关数据如下:
沸点(℃,1 atm) | ||||||
苯甲酸 | 苯甲酸乙酯 | 石油醚 | 水 | 乙醇 | 环己烷 | 共沸物(环己烷—水—乙醇) |
249 | 212.6 | 40~80 | 100 | 78.3 | 80.75 | 62.6 |
根据以上信息和装置图回答下述实验室制备有关问题:
(1)写出制备苯甲酸乙酯反应的化学方程式______________________________________,仪器a的名称______________,b口为冷凝水的_____________(填“进水口”或“出水口”)。
(2)请说出在本实验中可以采取的能提高苯甲酸乙酯产率的方法_________________(写出任意一种即可)。
(3)如何利用实验现象判断反应已基本完成______________________________________。
(4)固体NaHCO3的作用______________________________,加入固体NaHCO3时的实验操作所用到的主要玻璃仪器为____________________。
(5)经精馏得210~213℃馏分7.0 mL,则实验中苯甲酸乙酯的产率为__________。