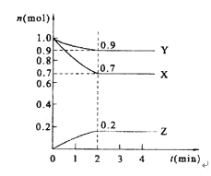
题目内容
【题目】下表为九种主族元素在周期表中的位置:
A | |||||||
E | F | ||||||
B | D | I | G | ||||
C | H | ||||||
请回答下列问题:
(1)I元素的位置是第________周期,第______族。
(2)C、B、D 三种元素的金属性由强到弱的顺序为_______(填元素符号)。
(3)E、F两种元素对应的最简单氢化物的稳定性:________________ (填化学式)。
(4)C的单质与水反应的离子方程式为_______。
(5)用电子式表示A和G形成化合物的过程:____。
【答案】三 IVA K>Na>Mg H2O>NH3 2K+2H2O = 2K+ +2OH-+H2↑ ![]()
【解析】
由元素在周期表中的位置,可确定A为H、B为Na、C为K、D为Mg、E为N、F为O、G为Cl、H为Br、I为Si。同周期元素,从左往右,金属性依次减弱,非金属性依次增强;同主族元素,从上到下,金属性依次增强,非金属性依次减弱。
(1)I元素为Si,电子排布为2、8、4,在周期表中的位置是第三周期第IVA族。答案为:三;IVA;
(2)C、B、D 三种元素分别为K、Na、Mg,K、Na同主族且K在Na的下方,Na、Mg同周期且Mg在Na的右方,金属性由强到弱的顺序为K>Na>Mg。答案为:K>Na>Mg;
(3) E为N、F为O,非金属性O>N,非金属性越强,其氢化物稳定性越强,则两种元素对应的最简单氢化物的稳定性:H2O>NH3。答案为:H2O>NH3;
(4)C为K,其单质与水发生置换反应,生成KOH和H2,离子方程式为2K+2H2O = 2K+ +2OH-+H2↑。答案为:2K+2H2O = 2K+ +2OH-+H2↑;
(5)A为H,G为Cl,二者形成共价化合物HCl,则电子式表示的形成过程为![]() 。答案为:
。答案为:![]() 。
。

练习册系列答案
相关题目