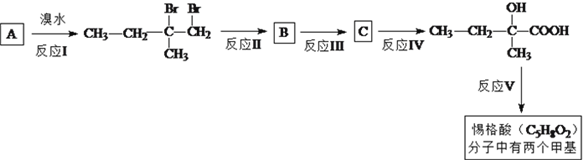
题目内容
【题目】(1)下列物质中①NaCl晶体 ②液态S03 ③醋酸 ④汞 ⑤BaS04固体 ⑥酒精 ⑦熔化的KN03 属于电解质的是(填序号)_________________________
(2)质量为3.9 g的Na2X中含有Na+的物质的量为0.1mol,则Na2X的摩尔质量为______,
(3)某气体对氧气的相对密度为2,则此气体的相对分子质量为______
(4)3.01×1022个S2-的物质的量为________,质量为________,含有质子的物质的量为______,含有电子的物质的量为________。
(5)某地酸雨经检验,除含氢离子外,还有如下离子:c(Na+)=1.4×10-3 mol·L-1 ,c(Cl-) =3.5×10-3 mol·L-1 ,c(NH) =2.3×10-3 mol·L-1 , c(SO![]() ) =1.5×10-3 mol·L-1。则该溶液中氢离子的浓度为_____________ mol·L-1。
) =1.5×10-3 mol·L-1。则该溶液中氢离子的浓度为_____________ mol·L-1。
【答案】① ③ ⑤ ⑦ 78g/mol 64 0.05mol 1.6g 0.8mol 0.9mol 2.8 ×10-3
【解析】
用电解质的概念去判断是否为电解质;依据质量和物质的量关系式,及阿伏加德罗定律推论去求摩尔质量和相对分子量,用溶液中离子电荷守恒,计算离子浓度。
(1).电解质是在溶液里或熔融状态下,可以导电的化合物。所以① ③ ⑤ ⑦是电解质。
(2).n(Na2X)=![]() n(Na+)=0.05mol,所以M(Na2X)=
n(Na+)=0.05mol,所以M(Na2X)=![]() =78g/mol。
=78g/mol。
(3).因为在相同的条件下,气体的密度之比等于相对分子量之比,所以此气体的相对分子质量为M=32![]() 2=64。
2=64。
(4).依据n=N/NA,求物质的量,n=m/M,求质量,硫原子质子数是16,S2-的电子数是18;所以3.01×1022个S2-的物质的量为0.05mol,质量为1.6g,含有质子的物质的量为0.8mol,含有电子的物质的量为0.9mol。
(5).因为溶液中阴、阳离子所带电荷是守恒的,所以有c(Na+)+c(NH)+c(H+)= c(Cl-)+2c(SO![]() ),解得c(H+)=2.8 ×10-3 mol·L-1。
),解得c(H+)=2.8 ×10-3 mol·L-1。