题目内容
【题目】常温下,用0.10 mol·L-1HCl溶液滴定20 mL 0.050 mol·L-1Na2CO3和0.025 mol·L-1NaHCO3混合溶液,得出如图所示的滴定曲线。下列说法不正确的是
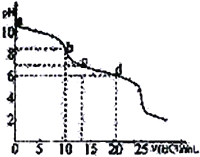
A. a点溶液显碱性的主要原因:CO32-+H2O![]() HCO3-+CH-
HCO3-+CH-
B. b点溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C. c点溶液中:c(Na+)=c(HCO3-)+2c(CO32-)+ c(Cl-)
D. d点溶液中:c(Na+)> c(Cl-)> c(HCO3-)>c(H+)>c(OH-)
【答案】B
【解析】A. a点溶液0.050mol·L-1 Na2CO3和0.025 mol·L-1 NaHCO3混合溶液,Na2CO3和NaHCO3均能水解使溶液呈碱性,但主要原因是CO32-的水解,故A正确。B. b点加入10mL HCl溶液后,溶液中的溶质为NaHCO3和NaCl,故B错误。C.据电荷守恒可知: c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(Cl-)+ c(OH-),由于c点溶液显中性,c(H+)= c(OH-),所以c(Na+)=c(HCO3-)+2c(CO32-)+c(Cl-),故C正确。D. d点加入20mL 0.10mol·L-1HCl溶液后,溶液中c(NaCl)=0.050 mol·L-1,c(NaHCO3)=0.0125mol·L-1,所以c(Na+)>c(Cl-)>c(HCO3-),又因为d点pH<7,所以c(H+)>c(OH-),故D正确。故选B。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案【题目】借助下表提供的信息,实验室制备乙酸丁酯所采取的措施正确的是
物质 | 乙酸 | 1-丁醇 | 乙酸丁酯 |
沸点 | 117.9℃ | 117.2℃ | 126.3℃ |
A. 采用水浴加热 B. 使用浓硫酸做催化剂
C. 用NaOH(aq)洗涤产物后分液 D. 边制备边蒸出乙酸丁酯
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂,广泛用于缺铁性贫血的预防和治疗。某学习小组在实验室利用直接合成法制各甘氨酸亚铁。有关物质性质如下所示:
甘氨酸( NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇、 | 易溶于水和乙醇, | 易溶于水, |
两性化合物 | 有强酸性和还原性 | 难溶于乙醇 |
实验过程及装置图如下(夹持和加热仪器已省略):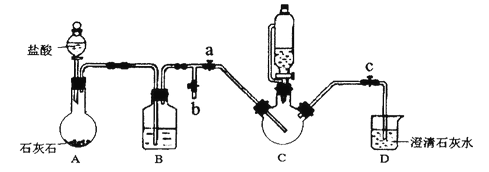
I.合成:在C中加入0.10mol甘氨酸、0.05mol硫酸亚铁、少量柠檬酸和200mL水,利用CO2将C装置中的空气排净,然后在40℃恒温条件下用磁力搅拌器不断搅拌,并用恒压滴液漏斗向C中滴加6mol·L-1NaOH溶液调节pH到6左右,使反应物充分反应。
II.分离:加入无水乙醇,立即出现白色沉淀。将沉淀进行过滤、洗涤,收集滤渣。
Ⅲ.提纯:将滤渣溶解于适量的蒸馏水中,然后结晶、过滤,将纯化后的产品放入真空干燥箱中干燥后称重。
回答下列问题:
(1)B装置的作用是______________;
(2)能证明C装置中空气排净的现象是______________;向C中滴加NaOH溶液之前应该停止滴加盐酸,且关闭止水夹____________,打开止水夹________
(3)“合成”中加入柠檬酸的作用是______________:请写出合成甘氨酸亚铁的化学方程式_________。
(4)加入乙醇的目的是________;“提纯”时用的结晶方法为________________
(5)通过测量得知:等浓度(NH2CH2COO)2Fe 溶液导电能力远小于FeSO4溶液。暴露在空气中,(NH2CH2COO)2Fe溶液比FeSO4溶液难被氧化,请分析原因为________
(6)若产品质量为ag,则产率为________ %。