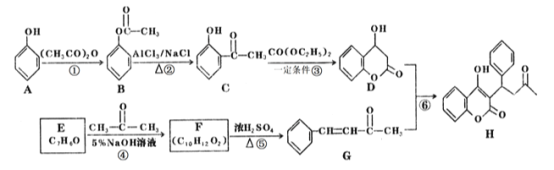
题目内容
【题目】惕格酸(C5H8O2,分子中有两个甲基)可用于制备香精,由烃A生成惕格酸的反应如下:
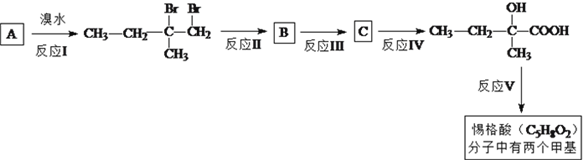
完成下列填空:
(1)写出反应类型。反应I:_____________反应、反应V:_______________反应。
(2)写出反应II试剂和反应条件:________________________________________。
(3)写出反应III的化学反应方程式:___________________________________________。
(4)如何检验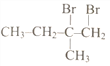 中的溴元素?____________________________________。
中的溴元素?____________________________________。
(5)写出符合下列条件的惕格酸的同分异构体的结构简式:_________________________。条件:与惕格酸含相同官能团,且也有两个甲基。 溴代甲基环己烷(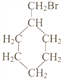 也可表示为
也可表示为![]() )可通过反应合成1-甲基环己烯(
)可通过反应合成1-甲基环己烯(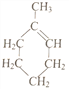 也可表示为
也可表示为![]() )
)
(6)设计一条以溴代甲基环己烷为原料合成1-甲基环己烯的合成路线。(合成路线常用的表示方式为: ![]() )________________
)________________
【答案】 加成 消除 NaOH水溶液,加热 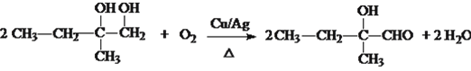 取样,向其中加入NaOH溶液,加热;再加稀硝酸至溶液显酸性,加AgNO3溶液产生淡黄色沉淀,则该有机物中含溴元素,反之则无
取样,向其中加入NaOH溶液,加热;再加稀硝酸至溶液显酸性,加AgNO3溶液产生淡黄色沉淀,则该有机物中含溴元素,反之则无 ![]()

【解析】(1)由下一种物质可推出反应I为加成反应,反应V为消除反应。
(2)反应II为卤代烃的水解反应所以条件为NaOH水溶液,加热
(3)反应III为醇的催化氧化,方程式为: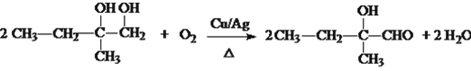
(4)因为卤代烃中的卤原子电离不出来,要想检验必须先让其水解,生成卤化氢再检验。方法为:取样,向其中加入NaOH溶液,加热;再加稀硝酸至溶液显酸性,加AgNO3溶液产生淡黄色沉淀,则该有机物中含溴元素,反之则无。
(5)惕格酸中含碳碳双键和羧基且有两个甲基,符合条件的同分异构体为:![]()
(6)有卤代烃到烯烃可以经过消去-加成-消去的方式得到,过程为:


【题目】SO2的催化氧化: ![]() ,是工业制取硫酸的关键步骤之一。在容积都为2L的
,是工业制取硫酸的关键步骤之一。在容积都为2L的![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五个密闭容器中,投入相同的催化剂,并均充入1mol O2和2mol SO2,控制不同的反应温度进行反应,反应进行到5min时,测得相关数据如下表:
五个密闭容器中,投入相同的催化剂,并均充入1mol O2和2mol SO2,控制不同的反应温度进行反应,反应进行到5min时,测得相关数据如下表:
容器温度 物质的量(mol) |
400℃ |
425℃ |
450℃ |
475℃ |
500℃ |
O2 | 0.8 | 0.6 | 0.3 | 0.5 | 0.7 |
SO3 | 0.4 | 0.8 | 1.4 | 1.0 | 0.6 |
(1)计算5min内![]() 容器中SO2的平均反应速率___________________________。
容器中SO2的平均反应速率___________________________。
(2)反应进行到5min时, ![]() 容器中的反应是否达到平衡状态?_______(填“已达”、“未达”)理由是:_________________________________________________
容器中的反应是否达到平衡状态?_______(填“已达”、“未达”)理由是:_________________________________________________
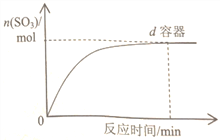
(3)在右图中画出![]() 容器中SO3物质的量随时间的变化曲线。____________
容器中SO3物质的量随时间的变化曲线。____________
(4)工业上常用Na2SO3溶液来吸收SO2,该反应的离子方程式是:______________________。
(5)Na2SO3和NaHSO3混合溶液的pH随Na2SO3和NaHSO3比例的不同而不同,数据如下:
序号 | ① | ② | ③ |
| 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
表中第________组(填写序号)数据,可判断NaHSO3溶液显_______性(填“酸”或“碱”)。
(6)NaHSO3既能和强酸反应也能和强碱溶液反应。用平衡移动原理说明NaHSO3能和强碱溶液反应的原因:_________________________________________________________。
【题目】借助下表提供的信息,实验室制备乙酸丁酯所采取的措施正确的是
物质 | 乙酸 | 1-丁醇 | 乙酸丁酯 |
沸点 | 117.9℃ | 117.2℃ | 126.3℃ |
A. 采用水浴加热 B. 使用浓硫酸做催化剂
C. 用NaOH(aq)洗涤产物后分液 D. 边制备边蒸出乙酸丁酯