题目内容
【题目】常温下,向10mL bmol·L-1的CH3COOH溶液中逐渐滴加等体积的0.01mol·L-1的NaOH溶液,充分反应后溶液中c(CH3COO-)=c(Na+),下列说法正确的是( )
A. b<0.01
B. 混合后溶液酸碱性无法判断
C. CH3COOH的电离常数Ka=![]()
D. 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小
【答案】C
【解析】常温下,向10mL bmol·L-1的CH3COOH溶液中逐渐滴加等体积的0.01mol·L-1的NaOH溶液,充分反应后溶液中c(CH3COO-)=c(Na+),依据溶液中电荷守恒分析可知溶液呈中性,醋酸略微过量,则A、恰好反应生成醋酸钠溶液呈碱性,若溶液呈中性,醋酸过量,b>0.01,A错误;B、根据以上分析可知溶液呈中性,B错误;C、溶液呈中性,c(OH-)=c(H+)=10-7mol/L,c(CH3COO-)=c(Na+)=0.005mol/L,电离平衡常数K=c(CH3COO)c(H+)/c(CH3COOH)=![]() ,C正确;D、随反应进行,水的抑制程度减弱,水电离程度增大,D错误;答案选C。
,C正确;D、随反应进行,水的抑制程度减弱,水电离程度增大,D错误;答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】SO2的催化氧化: ![]() ,是工业制取硫酸的关键步骤之一。在容积都为2L的
,是工业制取硫酸的关键步骤之一。在容积都为2L的![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五个密闭容器中,投入相同的催化剂,并均充入1mol O2和2mol SO2,控制不同的反应温度进行反应,反应进行到5min时,测得相关数据如下表:
五个密闭容器中,投入相同的催化剂,并均充入1mol O2和2mol SO2,控制不同的反应温度进行反应,反应进行到5min时,测得相关数据如下表:
容器温度 物质的量(mol) |
400℃ |
425℃ |
450℃ |
475℃ |
500℃ |
O2 | 0.8 | 0.6 | 0.3 | 0.5 | 0.7 |
SO3 | 0.4 | 0.8 | 1.4 | 1.0 | 0.6 |
(1)计算5min内![]() 容器中SO2的平均反应速率___________________________。
容器中SO2的平均反应速率___________________________。
(2)反应进行到5min时, ![]() 容器中的反应是否达到平衡状态?_______(填“已达”、“未达”)理由是:_________________________________________________
容器中的反应是否达到平衡状态?_______(填“已达”、“未达”)理由是:_________________________________________________
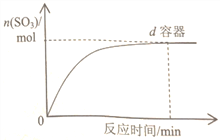
(3)在右图中画出![]() 容器中SO3物质的量随时间的变化曲线。____________
容器中SO3物质的量随时间的变化曲线。____________
(4)工业上常用Na2SO3溶液来吸收SO2,该反应的离子方程式是:______________________。
(5)Na2SO3和NaHSO3混合溶液的pH随Na2SO3和NaHSO3比例的不同而不同,数据如下:
序号 | ① | ② | ③ |
| 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
表中第________组(填写序号)数据,可判断NaHSO3溶液显_______性(填“酸”或“碱”)。
(6)NaHSO3既能和强酸反应也能和强碱溶液反应。用平衡移动原理说明NaHSO3能和强碱溶液反应的原因:_________________________________________________________。