题目内容
19.(1)等物质的量浓度的溶液中,水电离出的c(H+):HCl<CH3COOH(填“>、=、<”).(2)pH相同的溶液中:c(Na2CO3)<c(NaHCO3)(填“>、=、<”).
分析 (1)HCl水溶液溶液中完全电离,CH3COOH部分电离,水电离出的氢离子浓度和电离出的氢氧根离子浓度相同,结合溶液中离子积常数分析判断;
(2)碳酸钠中碳酸根离子水解程度大于碳酸氢根离子.
解答 解:(1)HCl水溶液溶液中完全电离,CH3COOH部分电离,等物质的量浓度的溶液中,HCl完全电离,氢离子浓度大,对水电离的抑制程度大,水电离出的氢离子浓度和电离出的氢氧根离子浓度相同,HCl溶液中水电离出的c水(H+)=c水(OH-)小,所以水电离出的c(H+):HCl<CH3COOH,
故答案为:<;
(2)碳酸钠中碳酸根离子水解程度大于碳酸氢根离子,pH相同的溶液中:c(Na2CO3)<c(NaHCO3),
故答案为:<.
点评 本题考查了水溶液中离子水解分析判断,影响水电离平衡因素分析,盐类水解的理解应用是解题关键,题目较简单.

练习册系列答案
相关题目
9.A、B、C、D、E是元素周期表中前四周期中五种常见元素,原子序数逐渐增大.相关信息如下表:
请回答下列问题:
(1)A在元素周期表中的位置第二周期第ⅣA族;E的基态原子核外电子排布式是1s22s22p63s23p63d64s2
(2)B、C、D的简单离子半径由大到小的顺序为(用元素符号表示)S2->O2->Al3+,A、B、D的气态氢化物是最稳定的是H2O (写分子式).
(3)A与C形成的化合物中,A为最低价.该化合物下盐酸反应的化学方程式为Al4C3+12HCl═4AlCl3+3CH4.
(4)处理含AO、DO2烟道气污染的一种方法是将其在催化剂作用下转化为单质D.
已知:2AO(g)+O2(g)=2AO2(g)△H=-566.0kJ•mol-1
D(s)+O2(g)=DO2(g)△H=-296.0kJ•mol-1
此反应的热化学方程式是2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1.
| 元素 | 相关信息 |
| A | 基态原子核外三个能级有电子,且每个能级上电子数目相同 |
| B | 其一种单质被称为地球生物的“保护伞” |
| C | 单质为常见金属,离子半径在同周期中最小 |
| D | 基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
| E | 有多种化合价,有一种氧化物为黑色磁性晶体 |
(1)A在元素周期表中的位置第二周期第ⅣA族;E的基态原子核外电子排布式是1s22s22p63s23p63d64s2
(2)B、C、D的简单离子半径由大到小的顺序为(用元素符号表示)S2->O2->Al3+,A、B、D的气态氢化物是最稳定的是H2O (写分子式).
(3)A与C形成的化合物中,A为最低价.该化合物下盐酸反应的化学方程式为Al4C3+12HCl═4AlCl3+3CH4.
(4)处理含AO、DO2烟道气污染的一种方法是将其在催化剂作用下转化为单质D.
已知:2AO(g)+O2(g)=2AO2(g)△H=-566.0kJ•mol-1
D(s)+O2(g)=DO2(g)△H=-296.0kJ•mol-1
此反应的热化学方程式是2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1.
10.下列实验的设计可行的是( )
| A. | 用澄清石灰水可区别Na2CO3和NaHCO3粉末 | |
| B. | 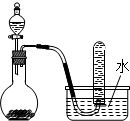 用如图装置进行浓硝酸与铜的反应制取并收集NO2 用如图装置进行浓硝酸与铜的反应制取并收集NO2 | |
| C. | 检验未知溶液是否含SO42ˉ可先加氯化钡,再加稀盐酸 | |
| D. | 除去粗盐中的Ca2+、Mg2+、SO42-,可依次加入H2O、NaOH、BaCl2、Na2CO3,过滤再加入HCl |
14.所有原子都满足最外层8电子稳定结构的化合物分子是( )
| A. | N2 | B. | PCl3 | C. | PCl5 | D. | BeCl2 |
11.一种元素最高价态的氧化物的水化物的化学式为H3XO4,则X的氢化物的化学式是( )
| A. | HX | B. | H2X | C. | XH3 | D. | XH4 |
2.海水中含有丰富的镁资源.某同学设计了从模拟海水中制备MgO的实验方案:
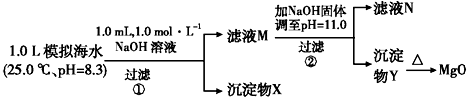
注:溶液中某种离子的浓度小于1.0×10-5 mol•L-1,可认为该离子不存在;
实验过程中,假设溶液体积不变.
KspCaCO3=4.96×10-9 KspMgCO3=6.82×10-6 KspCa(OH)2=4.68×10-6
KspMg(OH)2=5.61×10-12
下列说法不正确的是( )

| 模拟海水中的离 子浓度/mol•L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
实验过程中,假设溶液体积不变.
KspCaCO3=4.96×10-9 KspMgCO3=6.82×10-6 KspCa(OH)2=4.68×10-6
KspMg(OH)2=5.61×10-12
下列说法不正确的是( )
| A. | 沉淀物X为CaCO3、MgCO3 | |
| B. | 滤液M中存在Mg2+,Ca2+ | |
| C. | 滤液N中存在Ca2+,没有Mg2+ | |
| D. | 步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为仍Mg(OH)2,没有Ca(OH)2 |
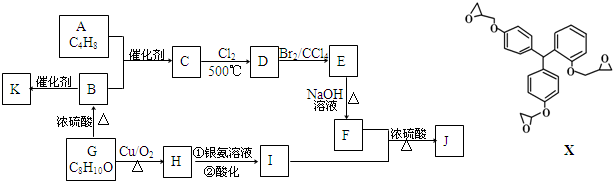
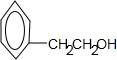 .
.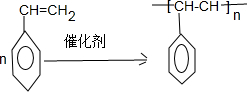 ;F+I→J
;F+I→J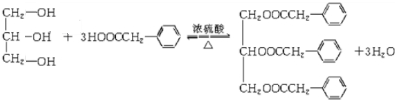 .
.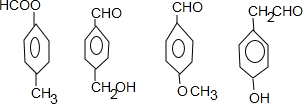 (其中三种).
(其中三种).