题目内容
14.所有原子都满足最外层8电子稳定结构的化合物分子是( )| A. | N2 | B. | PCl3 | C. | PCl5 | D. | BeCl2 |
分析 对于ABn的共价化合物,各元素满足|化合价|+元素原子的最外层电子数=8,原子都满足最外层8电子结构,据此结合选项判断.
解答 解:A、N2中N原子最外层5个电子,氮气结构式为N≡N,N原子形成3个共价键,每个共价键提供一个电子,所以每个N原子周围电子数为:5+3=8;但是N2为单质不是化合物,故A错误;
B、PCl3中P元素化合价为+3,P原子最外层电子数为5,所以3+5=8,P原子满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,故B正确;
C、PCl5中P元素化合价为+5,P原子最外层电子数为5,所以5+5=10,分子中P原子不满足8电子结构,故C错误;
D、BeCl2中Be元素化合价为+2,Be原子最外层电子数为2,所以2+2=4,Be原子不满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,故D错误.
故选B.
点评 本题考查8电子结构的判断,难度不大,清楚元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构是关键,注意单质和离子化合物不适合.

练习册系列答案
 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
4.下列有关热化学方程式及其叙述正确的是( )
| A. | 氢气的燃烧热为-285.5kJ/mo1,则电解水的热化学方程式为:2H2O(1)=2H2(g)+O2(g)△H=+285.5kJ/mo1 | |
| B. | 1mol甲烷完全燃烧生成CO2和H2O(1)时放出890kJ热量,则它的热化学方程式为:$\frac{1}{2}$CH4(g)+O2(g)=$\frac{1}{2}$CO2(g)+H2O(1)△H=-445kJ/mol | |
| C. | 已知:2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,则C的燃烧热为-110.5kJ/mo1 | |
| D. | HF与NaOH溶液反应:H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mol |
5.元素A和元素B的原子序数都小于18.已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的性质可能有( )
| A. | 能与水反应 | B. | 能与硫酸反应 | ||
| C. | 不能与氢氧化钠反应 | D. | 能与碳酸钠反应 |
9.下列各组给定原子序数的元素,不能形成原子数之比为1:1稳定共价化合物的是( )
| A. | 3和17 | B. | 1和8 | C. | 6和8 | D. | 1和6 |
6.下表是元素周期表的一部分,请回答有关问题:
(1)写出元素符号:B:C;E:Ne;F:Na.
(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与F最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(3)最高价氧化物的水化物碱性最强的物质的电子式 .用电子式表示F元素与J元素形成化合物的过程
.用电子式表示F元素与J元素形成化合物的过程
(4)A分别与D、J、K形成的化合物中,最稳定的HF(填化学式).
(5)在B、C、F、G、H中,原子半径最大的是Na(填元素符号).
 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | |||
| 4 | K |
(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与F最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(3)最高价氧化物的水化物碱性最强的物质的电子式
 .用电子式表示F元素与J元素形成化合物的过程
.用电子式表示F元素与J元素形成化合物的过程
(4)A分别与D、J、K形成的化合物中,最稳定的HF(填化学式).
(5)在B、C、F、G、H中,原子半径最大的是Na(填元素符号).
3.下列有机物属于芳香烃的是( )
| A. | 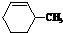 | B. | 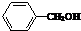 | C. |  | D. | 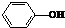 |
18.用向上排空气法收集Cl2和HCl时,可以用以检验瓶中是否已经充满又可区别两气体的是( )
| A. | 湿润的淀粉KI试纸 | B. | 蘸有浓氨水的玻璃棒 | ||
| C. | 湿润的蓝色石蕊试纸 | D. | 湿润的红色石蕊试纸 |