题目内容
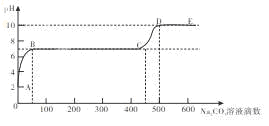
用已知浓度的盐酸滴定未知浓度的Na2CO3溶液。用pH传感器测得混合溶液的pH变化曲线如图(已知饱和CO2溶液pH为5.6),下列说法正确的是
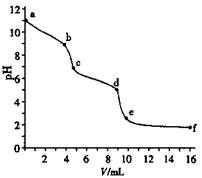

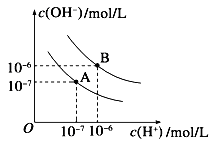
| A.该Na2CO3溶液的浓度为0.001 mol·L—1 |
| B.在pH ="6" 时,c(Na+)>c(HCO3—)>c(CO32—) |
| C.在pH ="7" 时,c(Na+)=c(Cl—) |
| D.c→d发生的主要离子反应:CO32—+H+=HCO3— |
B
试题分析:碳酸钠溶液中逐滴加入盐酸,先后发生的反应式为CO32—+H+=HCO3—、HCO3—+H+=H2O+CO2↑;A、碳酸钠溶液的初始pH=11,则此时溶液中c(OH—)=0.001mol/L,而OH—主要来自CO32—的水解,CO32—水解程度微弱,则c(Na2CO3)>0.001mol/L,错误;B、pH=6时,Na2CO3与HCl反应生成NaHCO3和NaCl、H2O、CO2,则溶液中c(Na+)>c(HCO3—)>c(CO32—),正确;C、pH=7时,Na2CO3与HCl反应生成NaHCO3和NaCl、H2O、CO2,c(OH—)=c(H+),由电荷守恒可知,c(Na+)=c(Cl—)+c(HCO3—)+2c(CO32—),错误;D、读图可知,a→b发生的主要离子反应:CO32—+H+=HCO3—,c→d发生的主要离子反应:HCO3—+H+=H2O+CO2↑,错误。

练习册系列答案
相关题目