题目内容
对于常温下pH为2的盐酸,叙述正确的是
| A.溶液中c(H+)=c(Cl—) |
| B.与等体积pH=12的氨水混合后所得溶液显酸性 |
| C.由盐酸电离出的H+约为由H2O电商出H+浓度的l010倍 |
| D.与等体积0.01 moI·L-1碳酸钠溶液混合后所得溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
C
试题分析:A、根据电荷守恒可知c(H+)=c(Cl—)+c(OH—),A不正确;B、一水合氨是弱碱,存在电离平衡,则pH=12的氨水溶液的浓度大于0.01mol/L,所以与pH=2的盐酸等体积混合后,氨水过量,溶液显碱性,B不正确;C、盐酸是强酸,抑制水的电离平衡。溶液中c(H+)=0.01mol/L,则根据水的离子积常数可知,溶液中c(OH—)=
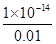 =1×10-12mol/L。溶液中c(OH—)=c水(H+)=1×10-12mol/L,所以由盐酸电离出的H+约为由H2O电商出H+浓度的l010倍,C正确;D、与等体积0.01 moI/L碳酸钠溶液混合,恰好反应生成碳酸氢钠和氯化钠。根据物料守恒可知c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),D不正确,答案选C。
=1×10-12mol/L。溶液中c(OH—)=c水(H+)=1×10-12mol/L,所以由盐酸电离出的H+约为由H2O电商出H+浓度的l010倍,C正确;D、与等体积0.01 moI/L碳酸钠溶液混合,恰好反应生成碳酸氢钠和氯化钠。根据物料守恒可知c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),D不正确,答案选C。
练习册系列答案
相关题目
 H++A-
H++A-
 HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。