题目内容
18.将下列浓溶液蒸干并灼烧,可以得到原溶质的是( )| A. | 氯化钠 | B. | 碳酸氢钠 | C. | 偏铝酸钠 | D. | 氯化铁 |
分析 从盐类水解的角度和物质的稳定性的角度分析,注意当水解生成挥发性酸时,加热蒸干并灼烧最终得到的是金属氧化物,当水解生成非挥发性酸时,加热蒸干并灼烧最终得到的是原物质.
解答 解:A.氯化钠溶液蒸干并灼烧,可以得到原溶质氯化钠,故A选;
B.NaHCO3不稳定,加热易分解,所以蒸干并灼烧生成Na2CO3,故B不选;
C.偏铝酸钠在溶液在加热时水解得到氢氧化铝与氢氧化钠,但氢氧化钠和氢氧化铝难挥发,最后又重新得到的固体偏铝酸钠,故C选;
D.FeCl3在加热时水解生成Fe(OH)3和HCl,HCl易挥发,灼烧得到Fe2O3,故D不选;
故选AC.
点评 本题考查盐类水解的应用,题目难度不大,注意盐类水解的原理,特别是能把握相关物质的性质.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
9.某元素R的最高价氧化物对应的水化物是HnRO2n,则在气态氢化物中R元素的化合价是( )
| A. | 3n | B. | 3n-8 | C. | -3n | D. | 8-3n |
6.为了确定有机物中是否存在氮、氯、溴、硫等元素,应将有机物样品与下列哪种金属混合熔融后,再无机定性分析( )
| A. | Fe | B. | Si | C. | Cu | D. | Na |
13.锗(Ge)是第32号元素,处于元素周期表中金属区与非金属区的交界线上,下列叙述中正确的是( )
| A. | 锗是一种金属性很强的元素 | B. | 锗化氢(GeH4)稳定性很强 | ||
| C. | 锗酸(H4GeO4)是难溶于水的强酸 | D. | 锗元素位于第四周期第ⅣA族 |
3.在下列变化过程中,被破坏的作用力正确的是( )
| A. | 干冰升华--共价键 | B. | 二氧化硅熔融--分子间作用力 | ||
| C. | 氢氧化钠熔融--离子键、共价键 | D. | 硫酸氢钠溶于水--离子键、共价键 |
10.下列属于放热反应的是( )
| A. | 浓硫酸的稀释 | B. | 铝热反应 | ||
| C. | 氢气还原氧化铜 | D. | 氢氧化钡晶体与氯化铵晶体混合 |
7.根据下列四种粒子的结构示意图,所获取的信息不正确的是( )
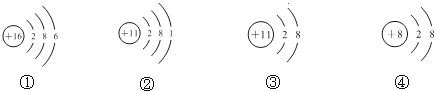
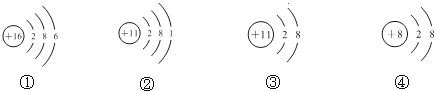
| A. | 它们表示三种元素 | |
| B. | ②③的化学性质相同 | |
| C. | ②表示的元素是金属元素 | |
| D. | ①表示的是原子,而④表示的是阴离子 |
8.下列电子式中,正确的是( )
| A. | 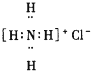 | B. | 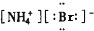 | C. | 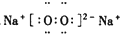 | D. | 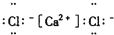 |
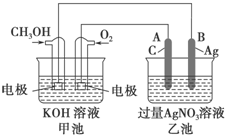 如图是一个化学过程的示意图.已知甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O
如图是一个化学过程的示意图.已知甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O