题目内容
13.锗(Ge)是第32号元素,处于元素周期表中金属区与非金属区的交界线上,下列叙述中正确的是( )| A. | 锗是一种金属性很强的元素 | B. | 锗化氢(GeH4)稳定性很强 | ||
| C. | 锗酸(H4GeO4)是难溶于水的强酸 | D. | 锗元素位于第四周期第ⅣA族 |
分析 A、处于金属区与非金属区的交界线上的元素金属性和非金属性都较弱;
B、非金属性较弱,所以氢化物的稳定性很弱;
C、锗和硅处于同一主族,硅的非金属性强于锗,而非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D、第三周期最后一种元素是18号元素Ar,所以锗在第四周期,第14列.
解答 解:A、锗处于金属区与非金属区的交界线上,元素金属性和非金属性都较弱,反应中既不易得电子,也不易失去电子,故A错误;
B、锗处于金属区与非金属区的交界线上,元素金属性和非金属性都较弱,锗化氢(GeH4)稳定性很弱,故B错误;
C、锗和硅处于同一主族,主族元素的非金属性从上到下逐渐减弱,则硅的非金属性大于锗,非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性比硅酸弱,为弱酸;碳酸溶液水,硅酸不溶于水,推知锗酸(H4GeO4)应难溶于水,故C错误;
D、锗(Ge)是第四周期第ⅣA 元素,处于周期表中金属区与非金属区的交界线上,故D正确;
故选D.
点评 本题考查位置结构性质的相互关系,题目难度不大,注意同主族元素的性质的递变性和相似性.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
4.下列有关原子核外电子排布的说法正确的是( )
| A. | 原子核外的电子总是尽先排在能量高的电子层里,然后才排在能量低的电子层 | |
| B. | 某原子的核电荷数与最外层电子数相等 | |
| C. | 原子核外的电子层分为七层,每层所排的电子数相同 | |
| D. | 某原子M层上电子数是L层上电子数的4倍 |
1.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)?NH3(g)+HI(g);
②2HI(g)?H2(g)+I2(g)
达到平衡时,c(H2)=0.25mol/L,c(HI)=5mol/L,
则此温度下反应①的平衡常数(单位:mol2•L-2)为( )
①NH4I(s)?NH3(g)+HI(g);
②2HI(g)?H2(g)+I2(g)
达到平衡时,c(H2)=0.25mol/L,c(HI)=5mol/L,
则此温度下反应①的平衡常数(单位:mol2•L-2)为( )
| A. | 25 | B. | 0.025 | C. | 30.25 | D. | 27.5 |
18.将下列浓溶液蒸干并灼烧,可以得到原溶质的是( )
| A. | 氯化钠 | B. | 碳酸氢钠 | C. | 偏铝酸钠 | D. | 氯化铁 |
5.A、B、C、D为原子序数依次增大的四种短周期元素,其性质或结构信息如下表:
试回答以下问题
(1)B在周期表中的位置是第二周期第ⅤA族,B的氢化物与E的氢化物比较,沸点较高的是NH3(填化学式).
(2)D3B可与水反应生成2种碱性物质,请写出这一化学方程式Na3N+3H2O=3NaOH+NH3↑.
(3)写出丙的电子式为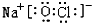 .丙在水溶液中的电离方程式NaClO=Na++ClO-.
.丙在水溶液中的电离方程式NaClO=Na++ClO-.
(4)由B、C、D三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈中性.将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成蓝色溶液,写出该反应的离子方程式3Cu+8H++2=3Cu2++2NO↑+4H2O.
| 元素 | A | B | C | D | E |
| 性质 或结 构信 息 | 室温下单质呈气态,原子最外层电子数与D相同 | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,甲有强氧化性 | 单质质软、银白色固体、导电性强,在空气中燃烧生成淡黄色固体 | E的气态氢化物和最高价氧化物对应的水化物均为强酸,C、D和E三种元素形成的一种盐丙为某消毒液的主要成分 |
(1)B在周期表中的位置是第二周期第ⅤA族,B的氢化物与E的氢化物比较,沸点较高的是NH3(填化学式).
(2)D3B可与水反应生成2种碱性物质,请写出这一化学方程式Na3N+3H2O=3NaOH+NH3↑.
(3)写出丙的电子式为
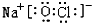 .丙在水溶液中的电离方程式NaClO=Na++ClO-.
.丙在水溶液中的电离方程式NaClO=Na++ClO-.(4)由B、C、D三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈中性.将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成蓝色溶液,写出该反应的离子方程式3Cu+8H++2=3Cu2++2NO↑+4H2O.
2.根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价] | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R | B. | 单质与稀盐酸反应的速率为L<Q | ||
| C. | L2+与R2-的核外电子数相等 | D. | M与T形成的化合物具有两性 |
3.X和Y的原子序数都小于两者能组成化合物X2Y3,已知X的原子序数为n,则Y的原子序数不可能是( )
| A. | n+11 | B. | n-5 | C. | n+3 | D. | n-6 |
 Na2O
Na2O CO2
CO2 .
.