题目内容
5.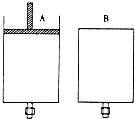 有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两只容器中分别充入等量的体积比为2:1的SO2与O2的混合气体,并使A和B容积相等(如图).在保持400℃的条件下使之发生如下反应:
有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两只容器中分别充入等量的体积比为2:1的SO2与O2的混合气体,并使A和B容积相等(如图).在保持400℃的条件下使之发生如下反应:2SO2(g)+O2$?_{△}^{催化剂}$2SO3(g),填写下列空格.
(1)达到平衡时所需的时间A容器比B容器短,A容器中SO2的转化率比B容器大.
(2)达到上述平衡后,若向两容器中通入数量不多的等量氩气,A容器化学平衡向逆反应方向移动移动,B容器化学平衡不移动移动.
(3)达到上述平衡后,若向两容器中通入等量的原反应气体,达到平衡时,A容器中SO3的体积分数与原平衡相比不变(填“增大”、“减小”或“不变”);B容器中SO3的体积分数与原平衡相比增大(填“增大”、“减小”或“不变”).
分析 (1)根据化学反应速率越快,到达平衡的时间越短;利用等效平衡来判断平衡移动来解答;
(2)根据容器中的压强对化学平衡的影响;
(3)根据浓度对化学平衡的影响,求出平衡移动后SO3的体积分数.
解答 解:(1)因A容器保持恒压,反应过程中体积变小,浓度增大,根据浓度越大,化学反应速率越快,到达平衡的时间越短,所以达到平衡所需时间A比B短,若A容器保持恒容,两容器建立的平衡等效,而实际上A容器体积减少,压强增大,平衡向正反应方向移动,所以A中SO2的转化率比B大,故答案为:短;大;
(2)平衡后,若向两容器通入数量不多的等量氩气,A容器体积增大,压强不变,参加反应的气体产生的压强减少,平衡向逆反应方向移动,B容器体积不变,压强增大,参加反应的气体产生的压强不变,平衡不移动,
故答案为:向逆反应方向移动,不移动;
(3)向两容器中通入等量的原反应气体,达到平衡后,A中建立的平衡与原平衡等效,所以SO3的体积分数不变,B容器中建立的平衡相当于在原平衡的基础上增大压强,平衡正向移动,B容器中SO3的体积分数增大,
故答案为:不变;增大.
点评 本题考查化学平衡移动的判断,本题难度中等,注意等效平衡的理解和应用,掌握基础是解题关键.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
13.下列各表述与示意图一致的是( )
| A. | 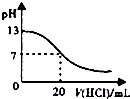 如图表示室温时,用0.1 mol.L-1 盐酸滴定0.1 mol•L-1NaOH溶液过程中的pH变化 | |
| B. | 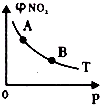 T℃时,反应2NO2(g)  N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图所示,则A点的颜色深,B点的颜色浅 N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图所示,则A点的颜色深,B点的颜色浅 | |
| C. | 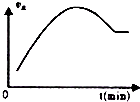 如图表示向绝热恒容密闭容器中通入A2和B2,一定条件下使反应2A2(g)+B2(g)?2C(g)达到平衡,正反应速率随时间变化的示意图.由图可得出的结论是:反应物的总能量低于生成物的总量 | |
| D. | 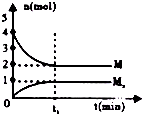 如图在恒温恒容的密闭容器中,气体M存在如下关系xM(g)?Mx(g),t1时刻,保持温度不变,再充入1mol M,重新达到平衡时$\frac{c(Mx)}{c(M)}$将增大 |
10.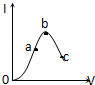 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,下列叙述正确的是( )
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,下列叙述正确的是( )
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,下列叙述正确的是( )
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,下列叙述正确的是( )| A. | a、b、c三点处,溶液c(H+)由小到大的顺序为a、b、c | |
| B. | a、b、c三点处,电离程度最大的是b | |
| C. | a、b、c三点处,c(CH3COO-)最大的是c | |
| D. | 若使c点溶液中c(CH3COO-)增大,可采取的措施有加入NaOH固体或加热 |
14.在标准状况下,112mL某气体的质量为0.16g,该气体可能是( )
| A. | O2 | B. | N2 | C. | H2S | D. | CO2 |
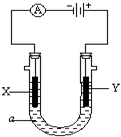 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.