题目内容
10.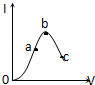 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,下列叙述正确的是( )
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,下列叙述正确的是( )| A. | a、b、c三点处,溶液c(H+)由小到大的顺序为a、b、c | |
| B. | a、b、c三点处,电离程度最大的是b | |
| C. | a、b、c三点处,c(CH3COO-)最大的是c | |
| D. | 若使c点溶液中c(CH3COO-)增大,可采取的措施有加入NaOH固体或加热 |
分析 A、导电能力越强,离子浓度越大,氢离子浓度越大;
B、溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大,电离程度越大;
C、导电能力越强,离子浓度越大,氢离子浓度越大,醋酸根离子浓度越大;
D、使c(CH3COO-)增大,则使醋酸的电离平衡正移,或增加醋酸根的量.
解答 解:A、由于导电能力越强,溶液中离子浓度越大,氢离子浓度越大,溶液c(H+)由小到大的顺序为c<a<b,故A错误;
B、溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大,电离程度越大,所以电离程度的是c,故B错误;
C、导电能力越强,离子浓度越大,醋酸根离子浓度越大,a、b、c三点处,c(CH3COO-)最大的是b,故C错误;
D、加入固体NaOH,消耗氢离子,则醋酸的电离平衡正移,c(CH3COO-)增大,加热促进醋酸电离,则醋酸的电离平衡正移,c(CH3COO-)增大,故D正确;
故选D.
点评 本题考查了弱电解质的电离,题目难度不大,注意把握决定溶液导电性的因素、影响电离平原的因素等知识点.

练习册系列答案
相关题目
20.相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)?2NH3(g)△H=-92.6kJ/moL.实验测得起始、平衡时得有关数据如下表:
下列叙述错误的是( )
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系 能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
| A. | 容器②中达平衡时放出的热量Q=23.15 kJ | |
| B. | 平衡时,两个容器中NH3的体积分数均为$\frac{1}{7}$ | |
| C. | 容器①、②中反应的平衡常数相等 | |
| D. | 若容器①体积为0.5L,则平衡时放出的热量<23.15kJ |
18.下列说法不正确的是( )
| A. | 碱性氧化物一定是金属氧化物 | |
| B. | Na2O、Na2O2组成元素相同,阳离子与阴离子个数比也相同 | |
| C. | Na2O2、HClO、SO2等物质都具有漂白作用 | |
| D. | 共价化合物固态时不导电,熔融态时导电 |
15.用两支惰性电极插入500mLAgNO3溶液中,通电电解.当电解液的pH从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上析出银的质量大约是( )
| A. | 27mg | B. | 54mg | C. | 108mg | D. | 216mg |
2.下列说法正确的是( )
| A. | 胶体区别于其他分散系的本质依据是具有丁达尔效应 | |
| B. | 通电时,溶液中的溶质粒子分别向两极移动,胶体粒子也一定会向某一极移动 | |
| C. | 纳米材料粒子直径一般在10-9m与10-7m之间,因此纳米材料属于胶体 | |
| D. | 在江河入海处容易形成沙洲与胶体的聚沉有关 |

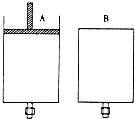 有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两只容器中分别充入等量的体积比为2:1的SO2与O2的混合气体,并使A和B容积相等(如图).在保持400℃的条件下使之发生如下反应:
有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两只容器中分别充入等量的体积比为2:1的SO2与O2的混合气体,并使A和B容积相等(如图).在保持400℃的条件下使之发生如下反应: