题目内容
15.反应4A(s )+3B(g)?2C(g)+D(g),经2min,B的浓度减少0.6mol•L-1.对此反应速率的表示,正确的是( )①用A表示的反应速率是0.4mol•L-1•min-1
②分别用B、C、D表示的反应速率其比值为3:2:1
③在2min末的反应速率,用B表示是0.3mol•L-1•min-1
④反应的过程中,只增加A的量,反应速率不变.
| A. | ①② | B. | ③ | C. | ① | D. | ②④ |
分析 ①.化学反应速率表示单位时间内浓度的变化量,一般不用固体或纯液体来表示反应速率;
②.速率之比等于化学计量数之比;
③.化学反应速率为一段时间内平均速率,不是即时速率;
④.A为固体,改变用量不影响反应速率.
解答 解:①.物质A是固体,浓度不变,不能用A表示该反应的反应速率,故①错误;
②.速率之比等于化学计量数之比,v(B):v(C):v(D)=3:2:1,故②正确;
③.2min末的反应速率为即时速率,用B表示速率0.3mol/(L?min)是2min内的平均速率,故③错误;
④.物质A是固体,只增加A的量,反应速率不变,故④正确;
故选D.
点评 本题考查反应速率的运用及表示方法,难度不大.要注意一般不用固体或纯液体来表示反应速率,掌握基础是关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列说法正确的是( )
| A. | 对于有气体参与的反应,增大压强,活化分子总数增多,化学反应速率增大 | |
| B. | 对放热反应而言,升高温度,活化分子百分数减少,化学反应速率减小 | |
| C. | 活化分子间发生的碰撞为有效碰撞 | |
| D. | 使用催化剂,活化分子百分数增多,化学反应速率增大 |
7.为了同时除去混在CO2气体中的杂质HCl和SO2,应选用的试剂是( )
| A. | NaOH溶液 | B. | 饱和NaHCO3溶液 | C. | Na2CO3溶液 | D. | CaO固体粉末 |
4.在101kPa时,测得氢气燃烧的热化学方程表示式如下:
①2H2(g)+02(g)=2H20(1)△H=-571.6kJ/mol
②2H2(g)+02(g)═2H20(g)△H=-483.6kJ/mol
则H2的燃烧热为( )
①2H2(g)+02(g)=2H20(1)△H=-571.6kJ/mol
②2H2(g)+02(g)═2H20(g)△H=-483.6kJ/mol
则H2的燃烧热为( )
| A. | -285.8kJ/mol | B. | 285.8kJ/mol | C. | -241.8 kJ/mol | D. | 241.8kJ/md |
5.下列一种变化与其它三种变化有本质区别,这种变化是( )
| A. | 碳燃烧产生气体 | B. | 硫燃烧产生气体 | ||
| C. | 高锰酸钾加热产生气体 | D. | 水加热产生气体 |
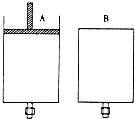 有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两只容器中分别充入等量的体积比为2:1的SO2与O2的混合气体,并使A和B容积相等(如图).在保持400℃的条件下使之发生如下反应:
有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两只容器中分别充入等量的体积比为2:1的SO2与O2的混合气体,并使A和B容积相等(如图).在保持400℃的条件下使之发生如下反应: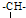 和一个-Cl,它的可能结构有四种,请写出这四种可能的结构简式:
和一个-Cl,它的可能结构有四种,请写出这四种可能的结构简式: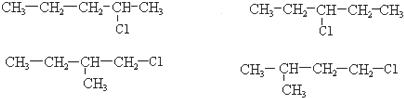 .
.