题目内容
15.某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤.
步骤2:边搅拌边向溶液中滴加稀硫酸至溶液pH=8~9,静置、过滤、洗涤.
步骤3:将步骤2中得到的固体溶于足量的稀硫酸.
步骤4:将得到的溶液范发浓缩、冷却、结晶、过滤、干燥.
请回答以下问题:
(1)上述实验中的过滤操作需要玻璃棒、烧杯、漏斗等玻璃仪器.
(2)步骤1过滤的目的是除去铁等不溶于碱的杂质.
(3)当步骤2中溶液的pH=8~9时,检验沉淀是否完全的方法是取上层清液,逐滴加入稀硫酸,若变浑浊则说明沉淀不完全,若不变浑浊则说明沉淀完全.
(4)步骤2中溶液的pH较难控制,可改用通入足量CO2气体.
分析 根据实验步骤可知:由含铁废铝制备硫酸铝晶体原理是用氢氧化钠溶液溶解铝,过滤除掉杂质铁,然后调节PH得到氢氧化铝沉淀,氢氧化铝和稀硫酸溶液反应生成硫酸铝,蒸发浓缩、冷却、结晶、过滤、干燥后得到硫酸铝固体.
(1)过滤操作中需要的玻璃仪器有:烧杯、漏斗、玻璃棒;
(2)Al能与氢氧化钠溶液反应,铁不能与氢氧化钠溶液反应,过滤为了固液分离;
(3)沉淀完全后上层清液里就没有AlO2-,只要检验上层清液里有无AlO2-就可以了;
(4)根据氢氧化铝不能被碳酸溶解,偏铝酸钠可以和二氧化碳之间反应生成氢氧化铝沉淀来回答.
解答 解:根据实验步骤可知:由含铁废铝制备硫酸铝晶体原理是用氢氧化钠溶液溶解铝,过滤除掉杂质铁,然后调节PH得到氢氧化铝沉淀,氢氧化铝和稀硫酸溶液反应生成硫酸铝,蒸发浓缩、冷却、结晶、过滤、干燥后得到硫酸铝固体.
(1)过滤操作中需要大小烧杯各一个、过滤器需要漏斗、玻璃棒用作引流,因此过滤操作中需要的玻璃仪器有:烧杯、漏斗、玻璃棒,
故答案为:烧杯;漏斗;
(2)Al能与氢氧化钠溶液反应,铁不能与氢氧化钠溶液反应,通过过滤将杂质铁从溶液中除掉,故答案为:除去铁等不溶于碱的杂质;
(3)检验沉淀是否完全的方法是取上层清液,逐滴加入稀硫酸,若变浑浊则说明沉淀不完全,若不变浑浊则说明沉淀完全,
故答案为:取上层清液,逐滴加入稀硫酸,若变浑浊则说明沉淀不完全,若不变浑浊则说明沉淀完全;
(4)边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,目的是生成氢氧化铝,可利用往偏铝酸钠溶液中通入足量CO2气体的方法,2H2O+AlO2-+CO2=Al(OH)3↓+HCO3-,不必控制溶液的PH就可得到最大量的沉淀,故答案为:通入足量CO2气体.
点评 本题考查金属铝的重要性质和实验操作,铝能与强碱性溶液反应是其他一般金属不具有的化学性质,掌握化学反应原理才能分析出实验步骤的目的,整合性较强,难度一般.

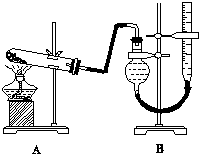 某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:(一)制取氧化铜
①称取2g CuSO4•5H2O研细后倒入烧杯,加10mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用.
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是①②③(填实验序号),步骤①③中研磨固体所用仪器的名称是研钵;
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,相关数据如下:
| 实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
| ④ | 1.2g | 无其他物质 | |
| ⑤[ | 1.2g | CuO 0.5g | |
| ⑥ | 1.2g | MnO2 0.5g |
(2)上述实验中“待测数据”指产生25mL气体所需时间;
(3)本实验装置图中量气装置B由干燥管、乳胶管和50mL滴定管改造后组装而成,此处所用滴定管是碱式(选填“酸式”或“碱式”)滴定管;读数时需要注意①上下移动右管使两液面相平; ②视线与刻度线相平
(4)为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a.检测CuO反应前后质量是否改变,
b.CuO的化学性质有没有改变.
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系 能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
| A. | 容器②中达平衡时放出的热量Q=23.15 kJ | |
| B. | 平衡时,两个容器中NH3的体积分数均为$\frac{1}{7}$ | |
| C. | 容器①、②中反应的平衡常数相等 | |
| D. | 若容器①体积为0.5L,则平衡时放出的热量<23.15kJ |
| A. | 钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同 | |
| B. | 新制饱和氯水和浓硝酸光照下会有气体产生,其成分中有氧气 | |
| C. | 次氯酸和过氧化钠都能使品红溶液褪色,其原理是不相同的 | |
| D. | Mg在CO2中燃烧生成MgO和C,在该反应条件下,Mg的还原性强于C的还原性 |

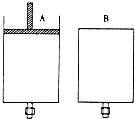 有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两只容器中分别充入等量的体积比为2:1的SO2与O2的混合气体,并使A和B容积相等(如图).在保持400℃的条件下使之发生如下反应:
有两只密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两只容器中分别充入等量的体积比为2:1的SO2与O2的混合气体,并使A和B容积相等(如图).在保持400℃的条件下使之发生如下反应: