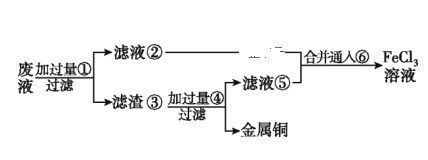
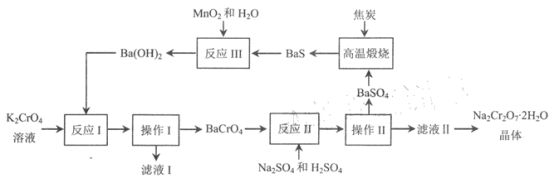
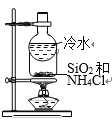
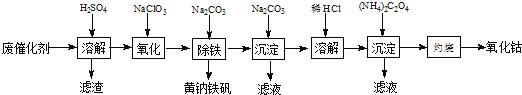
题目内容
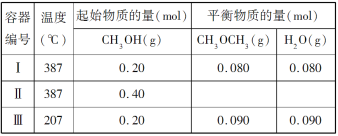
【题目】一定温度下,在三个体积均为 1.0 L 的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
下列说法正确的是( )
A.该反应的正反应为吸热反应
B.达到平衡时,容器Ⅰ中的 CH3OH 体积分数比容器Ⅱ中的小
C.容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D.若起始时向容器Ⅰ中充入 CH3OH 0.15 mol、CH3OCH3 0.15 mol 和 H2O 0.10 mol,则反应将 向正反应方向进行
【答案】D
【解析】
A. 容器I和容器III中CH3OH起始物质的量相等,容器Ⅰ的温度高于容器III,达到平衡时容器I中生成物的物质的量小于容器III中,说明降低温度,平衡向正反应方向移动,则正反应是放热反应,故A错误;
B. 恒容条件下,容器Ⅱ相当于在容器Ⅰ的基础上加压,但由于该反应是反应前后气体体积不变的反应,因此平衡不移动,所以容器Ⅰ中的CH3OH体积分数和容器Ⅱ中的相等,故B错误;
C. 容器Ⅰ中的温度比容器III的温度高,温度越高反应速率越快,达到平衡所需时间越短,故C错误;
D. 容器Ⅰ中平衡时c(CH3OCH3)=c(H2O)=![]() =0.080mol/L, c(CH3OH)=
=0.080mol/L, c(CH3OH)=![]() =0.04mol/L,容器Ⅰ中化学平衡常数K=
=0.04mol/L,容器Ⅰ中化学平衡常数K=![]() =4,若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH30.15 mol和H2O 0.10 mol, 则起始浓度c(CH3OH)=0.15mol/L、c(CH3OCH3)=0.15mol/L、c(H2O)=0.10mol/L,浓度商Qc=
=4,若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH30.15 mol和H2O 0.10 mol, 则起始浓度c(CH3OH)=0.15mol/L、c(CH3OCH3)=0.15mol/L、c(H2O)=0.10mol/L,浓度商Qc=![]() =0.67<4,平衡向正反应方向进行,故D正确;
=0.67<4,平衡向正反应方向进行,故D正确;
答案选D。

【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=_________________。
(2)反应Ⅲ能够自发进行的条件是_______________(填“较低温度” “较高温度”或“任何温度” )。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是______。
A.混合气体的密度不再变化 B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
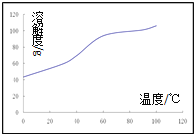
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是__________。

A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250 ℃时,随温度升高甲醇的产率增大
C.M 点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)已知下列物质在20℃下的Ksp如下,试回答下列问题:
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 货色 | 黑色 | 红色 |
Ksp | 1.8×10-10 | 5.4×10-13 | 8.3×10-17 | 6.3×10-50 | 2.0×10-12 |
①20℃时,上述五种银盐饱和溶液中,Ag+物质的量浓由大到小的顺序是____________。
②向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时c(Br-)/c(Cl-)=________________。
③ 测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是____。
A.KBr B.KI C.K2S D.K2CrO4
(6)已知25℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33。
①在25℃下,向浓度均为0.1 mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成______________沉淀(填化学式)。
②溶液中某离子物质的量浓度低于1.0×10-5 mol·L-1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2mol·L-1。此时所得沉淀中___________(填“还含有”或“不含有”)Al(OH)3,并请写出计算过程。