题目内容
11.氯气溶于水形成如下平衡:Cl2+H2O?HCl+HClO,(1)向氯水中加入几滴碳酸钠溶液,c (HCl)变小、c(HClO)变大(填“变大”、“变小”或“不变”),写出反应的离子方程式CO32-+2H+=H2O+CO2↑.
(2)将氯水光照,c(HCl)变大、c(HClO)变小(填“变大”、“变小”或“不变”),原因是(用化学方程式表示)2HClO2HCl+O2↑.
分析 (1)盐酸溶液酸性大于次氯酸,向氯水中加入几滴碳酸钠溶液和盐酸发生反应生成二氧化碳,次氯酸不反应,氯气和水反应的化学平衡正向进行;
(2)氯水中存在次氯酸,次氯酸见光分解生成氯化氢和氧气,氯水中平衡正向进行,HCl浓度增大,次氯酸浓度减小;
解答 解:(1)盐酸溶液酸性大于次氯酸,向氯水中加入几滴碳酸钠溶液,少量碳酸钠和盐酸发生反应生成二氧化碳,反应的离子方程式为:CO32-+2H+=H2O+CO2↑,次氯酸不反应,氯气和水反应的化学平衡正向进行,HCl浓度减小,HClO浓度增大.
故答案为:变小,变大,CO32-+2H+=H2O+CO2↑;
(2)氯水中存在次氯酸,次氯酸见光分解生成氯化氢和氧气,氯水中Cl2+H2O?HCl+HClO,平衡正向进行,HCl浓度增大,次氯酸分解浓度减小;
故答案为:变大、变小,2HClO2HCl+O2↑.
点评 本题考查了弱电解质电离平衡,化学平衡的影响因素分析,主要是酸性强弱的理解应用和离子方程式的书写,题目较简单.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
1.下列表示物质结构的化学用语或模型图正确的是( )
| A. | HClO的结构式:H-Cl-O | B. | 14C的原子结构示意图: | ||
| C. | 聚氯乙烯的结构简式: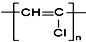 | D. | 丙烷分子的球棍模型示意图: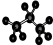 |
2.化学与生活密切相关,下列说法正确的是( )
| A. | 使用填埋法处理未经分类的生活垃圾 | |
| B. | “地沟油”经过加工处理后可用来制肥皂 | |
| C. | 大量使用薪柴为燃料,践行低碳生活 | |
| D. | CO2、NO2或SO2的排放是形成酸雨的主要原因 |
19.下列说法正确的是( )
| A. | 根据反应Cu+H2SO4CuSO4+H2↑可推出Cu的还原性比H2的强 | |
| B. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 | |
| C. | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色,证明氧化性:H2O2比Fe3+强 | |
| D. | 在2Na+2C+2NH3=2NaCN+3H2↑反应中的还原剂为C和Na |
3.工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2•6H2O晶体,其工艺流程为:

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
(1)在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎等).
(2)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有漏斗、烧杯、玻璃棒.
(3)在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4.当pH=5时,溶液中c(Fe3+)=2.6×10-12 mol•L-1.(常温下Ksp[Fe(OH)3]=2.6×10-39).检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe3+沉淀完全.
(4)加入Zn粉的作用是除去溶液中的Cu2+.“操作A”的名称是冷却.

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2[ | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
(2)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有漏斗、烧杯、玻璃棒.
(3)在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4.当pH=5时,溶液中c(Fe3+)=2.6×10-12 mol•L-1.(常温下Ksp[Fe(OH)3]=2.6×10-39).检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe3+沉淀完全.
(4)加入Zn粉的作用是除去溶液中的Cu2+.“操作A”的名称是冷却.
20.下列说法正确的是( )
| A. | 含有极性键的分子一定是极性分子 | |
| B. | 键能越大,表示该分子越容易受热分解 | |
| C. | 在分子中,两个成键的原子间的距离叫做键长 | |
| D. | H-Cl的键能为431.8KJ/mol,H-I的键能为298.7 KJ/mol,这可以说明HCl比HI分子稳定 |
1.下列叙述正确的是( )
| A. | 分子式为C3H6有机物最多存在4个C-C单键,与C4H10的碳碳单键数相同 | |
| B. | 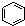 和 和 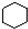 均是芳香烃, 均是芳香烃,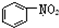 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| C. | 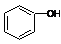 和 和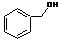 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
| D. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此推测可能有H-O键 |
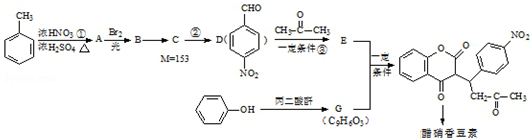
 +H2O
+H2O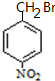 G
G
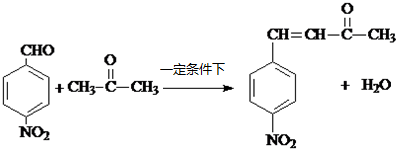
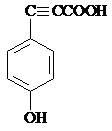 .
.