题目内容
12.X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:(1)X的元素名称为S.
(2)XZ2与YZ2分子的立体结构分别是V形和直线形,相同条件下两者在水中的溶解度较大的是SO2(写分子式),写出XZ2易溶于水的原因SO2与水能够反应生成亚硫酸,CO2可溶于水,同时SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大
(3)Q的元素符号是Cr,它的基态原子的核外电子排布式为1s22s22p63s23p63d54s1,在形成化合物时它的最高化合价为+6.
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键F-H…F、F-H…O、O-H…F、O-H…O.
分析 X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,则X为S元素,Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素,Z是地壳内含量最高的元素,则Z为O元素,Q的核电荷数是X与Z的核电荷数之和,原子序数为24,故Q为Cr元素,E在元素周期表的各元素中电负性最大,应为F元素,结合元素对应单质、化合物的结构和性质解答该题.
解答 解:X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,则X为S元素,Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素,Z是地壳内含量最高的元素,则Z为O元素,Q的核电荷数是X与Z的核电荷数之和,原子序数为24,故Q为Cr元素,E在元素周期表的各元素中电负性最大,应为F元素.
(1)由以上分析可知,X为硫元素,故答案为:硫;
(2)SO2中S和O形成2个δ键,有1个孤电子对,为V形,CO2中C和O形成2个δ键,没有孤电子对,为直线形;
SO2与水能够反应生成亚硫酸,CO2可溶于水,同时SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大,
故答案为:V形;直线形;SO2;SO2与水能够反应生成亚硫酸,CO2可溶于水,同时SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大;
(3)Q为Cr元素,原子序数为24,核外电子排布式为1s22s22p63s23p63d54s1,最高化合价为+6价,
故答案为:Cr;1s22s22p63s23p63d54s1;+6;
(4)HF溶液中存在的氢键有:F-H…F、F-H…O、O-H…F、O-H…O,
故答案为:F-H…F、F-H…O、O-H…F、O-H…O.
点评 本题是对物质结构的考查,注意把握原子核外电子排布推断元素的种类,注意(4)中氢键的表示,难度中等.

| A. | 使用填埋法处理未经分类的生活垃圾 | |
| B. | “地沟油”经过加工处理后可用来制肥皂 | |
| C. | 大量使用薪柴为燃料,践行低碳生活 | |
| D. | CO2、NO2或SO2的排放是形成酸雨的主要原因 |
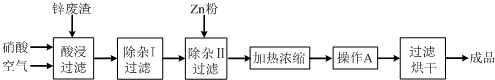
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2[ | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
(2)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有漏斗、烧杯、玻璃棒.
(3)在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4.当pH=5时,溶液中c(Fe3+)=2.6×10-12 mol•L-1.(常温下Ksp[Fe(OH)3]=2.6×10-39).检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe3+沉淀完全.
(4)加入Zn粉的作用是除去溶液中的Cu2+.“操作A”的名称是冷却.
| A. | 含有极性键的分子一定是极性分子 | |
| B. | 键能越大,表示该分子越容易受热分解 | |
| C. | 在分子中,两个成键的原子间的距离叫做键长 | |
| D. | H-Cl的键能为431.8KJ/mol,H-I的键能为298.7 KJ/mol,这可以说明HCl比HI分子稳定 |
| A. | VSEPR模型就是分子的空间构型 | |
| B. | 在共价化合物分子中一定存在σ键 | |
| C. | Na3[AlF6]、Na2[SiF6]和[Cu(NH3)4]Cl2的配位数都是6 | |
| D. | 共价键键长越短,键能一定越大 |
| A. | 分子式为C3H6有机物最多存在4个C-C单键,与C4H10的碳碳单键数相同 | |
| B. | 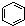 和 和 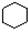 均是芳香烃, 均是芳香烃,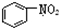 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| C. | 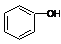 和 和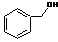 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
| D. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此推测可能有H-O键 |
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | B物质的分子量 | D. | 气体的总物质的量 |