题目内容
13.碳、氮、氧、铁、铜是常见的几种元素,请回答以下问题:(1)已知碳、氧、氯三种元素可形成CCl4、ClO2等物质,则C、O、Cl的电负性从大到小的顺序为O>Cl>C.
(2)基态铜原子的核外电子排布式为1s22s22p63s23p63d104s1.
(3)三氯化铁常温下为固体,熔点282~C,沸点315~C,易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁的晶体类型为分子晶体
(4)lmolCH3COOH分子中含有σ键数目为7mol.
(5)维生素B.可作为辅酶参与糖的代谢,并有保护神经系统的作用.该物质的结构式为:
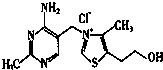
①维生素B.中碳原子的杂化轨道类型有sp2、sp3
②维生素B,晶体溶于水的过程中要克服的微粒间的作用力有D.
A.离子键、共价键
B.离子键、氢键、共价键
C.氢键、范德华力
D.离子键、氢键、范德华力
(6)通常酸式盐在水中的溶解度大于正盐,但NaHCO3的溶解度却小于Na2CO3,这是由于酸式根离子与离子之间形成氢键,CO32-比HCO3-多一个负电荷,水合作用强于HCO3-,而且HCO3-的H进入到CO3电子云程度很大,使CO3的负电荷进一步被中和,水合作用进一步降低,所以Na2CO3比NaHCO3的溶解度大.
分析 (1)非金属性O>Cl>C,非金属性越强电负性越大;
(2)Cu是29号元素,原子核外电子数为29,根据核外电子排布规律书写核外电子排布式;
(3)分子晶体熔沸点较低;
(4)单键都是σ键,双键和三键都是只有一个σ键;
(5)①根据价层电子对互斥理论确定其杂化类型;
②维生素B,晶体溶于水的过程中要克服的微粒间的作用力有分子间作用力和离子键;
(6)酸式盐在水中电离产生的酸式根离子与离子之间形成氢键,溶解度大于正盐,CO32-比HCO3-多一个负电荷,水合作用强于HCO3-,而且HCO3-的H进入到CO3电子云程度很大,使CO3的负电荷进一步被中和,水合作用进一步降低,所以Na2CO3比NaHCO3的溶解度大.
解答 解:(1)非金属性越强电负性越大,非金属性O>Cl>C,所以电负性:O>Cl>C,故答案为:O>Cl>C;
(2)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(3)分子晶体熔沸点较低,该物质的熔沸点较低,所以为分子晶体,故答案为:分子晶体;
(4)单键都是σ键,双键和三键都是只有一个σ键,CH3COOH中含有3个H-C键,1个C-Cl键,1个O-C键,1个O=C键,1个H-O键,故共有7个σ键,所以1mol CH3COOH中含有的σ键的数目为7mol,故答案为:7mol;
(5)①该化合物中连接双键的碳原子含有3个σ键,为sp2杂化,连接4个σ键的碳原子采用sp3杂化,故答案为:sp2、sp3;
②维生素B,晶体溶于水的过程中要克服的微粒间的作用力有范德华力、氢键和离子键,故选D;
(6)酸式盐在水中电离产生的酸式根离子与离子之间形成氢键,溶解度大于正盐,CO32-比HCO3-多一个负电荷,水合作用强于HCO3-,而且HCO3-的H进入到CO3电子云程度很大,使CO3的负电荷进一步被中和,水合作用进一步降低,所以Na2CO3比NaHCO3的溶解度大,
故答案为:酸式根离子与离子之间形成氢键,CO32-比HCO3-多一个负电荷,水合作用强于HCO3-,而且HCO3-的H进入到CO3电子云程度很大,使CO3的负电荷进一步被中和,水合作用进一步降低,所以Na2CO3比NaHCO3的溶解度大.
点评 本题考查了元素的电负性、价电子排布式的书写、分子结构的判断等知识点,知识点碎而多,要求学生会利用知识迁移的方法分析问题,难度较大.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案| 编号 | 气体 | a | b | c | 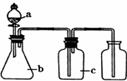 |
| A | NH3 | 浓氨水 | 生石灰 | 碱石灰 | |
| B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | |
| C | NO | 稀硝酸 | 铜屑 | H2O | |
| D | Cl2 | 浓盐酸 | 二氧化锰 | 饱和NaCl溶液 |
| A. | A | B. | B | C. | C | D. | D |

| A. | 每个四氢大麻酚分子中含有3个手性碳原子 | |
| B. | 四氢大麻酚能与FeCl3溶液发生显色反应 | |
| C. | 1mol四氢大麻酚最多可与1molBr2发生加成反应 | |
| D. | 1mol四氢大麻酚与NaOH溶液反应,最多消耗2molNaOH |

| A. | 离子半径:d3+<f- | |
| B. | 原子失电子能力:c>d | |
| C. | 最简单气态氢化物的热稳定性:a<e | |
| D. | b、c两元素可组成既含离子键又含共价键的化合物 |
甲:
 乙:
乙:
丙:
| 分子式 | C9H8O |
| 部分性质 | 能使Br2CCl4褪色 |
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
甲
 Y乙
Y乙其中反应I的反应类型是取代反应,反应II的条件是氢氧化钠水溶液、加热,反应III的化学方程式为
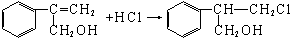 (不需注明反应条件).
(不需注明反应条件).(3)由甲出发合成丙的路线之一如图:

(a)下列物质不能与B反应的是bc(选填序号).
a.金属钠 b.FeCl3 c.碳酸钠溶液 d.HBr
(b)丙的结构简式为
 .
.(c)任写一种能同时满足下列条件的D的同分异构体结构简式
 、
、 、
、 任意一种.
任意一种.a.苯环上的一氯代物有两种
b.遇FeCl3溶液发生显色反应
c.能与发生加成反应.
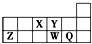
| A. | 离子半径的大小顺序为r(W2-)>r(Q-)>r(Y2-)>r(Z3+) | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Q的强 | |
| C. | 元素X与Q的氢化物化合的产物中既含共价键又含离子键 | |
| D. | X、Z、W、Q四种元素的最高价氧化物对应的水化物均能与强碱反应 |
| A. | Fe3+、K+、Na+、SO42- | B. | Na+、K+、CO32-、Cl- | ||
| C. | Mg2+、Na+、Cl-、NO3- | D. | Ba2+、K+、ClO-、SO42- |
| A. | NCl3分子中N-Cl键的键长比CCl4分子中C-Cl键的键长长 | |
| B. | NCl3分子是非极性分子 | |
| C. | 分子中的所有原子均达到8电子稳定结构 | |
| D. | NCl3不含孤电子对 |



 .
. .
. ,反应类型酯化反应.
,反应类型酯化反应. )
) .
.