题目内容
1.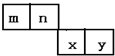 m、n、x、y四种主族元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则:
m、n、x、y四种主族元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则:(1)元素n的气态氢化物的分子式为NH3,空间构型为三角锥形
(2)m与y所形成的化合物含极性 键,属非极性分子.(填“极性”或“非极性”)
(3)x位于周期表的第三周期,第ⅥA族;其原子结构示意图为
 .
.(4)由n、y的氢化物相互作用所生成的物质的电子式为
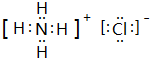 ,此物质在固态时属于离子晶体.
,此物质在固态时属于离子晶体.
分析 m、n、x、y四种主族元素,它们的原子序数总和为46,由它们在周期表里的相对位置可知,x、y不可能处于第四周期,因为第四周期中两种主族元素的原子序数最小为19+20=39,m与n的原子序数之和小于46-39,m、n不可能处于第三周期,故m、n处于第二周期,x、y处于第三周期,令m的原子序数为a,则n、x、y的原子序数分别为a+1、a+10、a+11,则a+a+1+a+10+a+11=46,解得a=6,故m为C元素、n为N元素、x为S元素、y为Cl元素,据此解答.
解答 解:m、n、x、y四种主族元素,它们的原子序数总和为46,由它们在周期表里的相对位置可知,x、y不可能处于第四周期,因为第四周期中两种主族元素的原子序数最小为19+20=39,m与n的原子序数之和小于46-39,m、n不可能处于第三周期,故m、n处于第二周期,x、y处于第三周期,令m的原子序数为a,则n、x、y的原子序数分别为a+1、a+10、a+11,则a+a+1+a+10+a+11=46,解得a=6,故m为C元素、n为N元素、x为S元素、y为Cl元素.
(1)元素n的气态氢化物的分子式为NH3,空间构型为:三角锥形,
故答案为:NH3;三角锥形;
(2)m与y所形成的化合物为CCl4,含极性键,分子为正四面体结构,分子中正负电荷重心重合,属于非极性分子,
故答案为:极性;非极性;
(3)x为S元素,位于周期表的第三周期第ⅥA族;其原子结构示意图为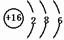 ,
,
故答案为:三、ⅥA;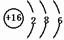 ;
;
(4)由n、y的氢化物相互作用所生成的物质为NH4Cl,由铵根离子与氯离子构成,电子式为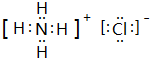 ,属于离子晶体,
,属于离子晶体,
故答案为: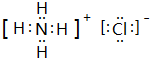 ;离子.
;离子.
点评 本题考查元素周期表、分子结构与性质、常用化学用语等,关键是确定元素所处周期推断元素,注意理解同主族元素原子序数关系.


| A. | 离子半径的大小顺序为r(W2-)>r(Q-)>r(Y2-)>r(Z3+) | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Q的强 | |
| C. | 元素X与Q的氢化物化合的产物中既含共价键又含离子键 | |
| D. | X、Z、W、Q四种元素的最高价氧化物对应的水化物均能与强碱反应 |
| A. | Fe3+、K+、Na+、SO42- | B. | Na+、K+、CO32-、Cl- | ||
| C. | Mg2+、Na+、Cl-、NO3- | D. | Ba2+、K+、ClO-、SO42- |
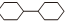 ,它的二氯代物且氯原子不在同一个环上的同分异构体的个数是( )
,它的二氯代物且氯原子不在同一个环上的同分异构体的个数是( )| A. | 13 | B. | 12 | C. | 11 | D. | 10 |
| A. | NCl3分子中N-Cl键的键长比CCl4分子中C-Cl键的键长长 | |
| B. | NCl3分子是非极性分子 | |
| C. | 分子中的所有原子均达到8电子稳定结构 | |
| D. | NCl3不含孤电子对 |
| A. | 一定有H2、CO2和HCl | B. | 一定有CO、CO2和水蒸气 | ||
| C. | 一定没有CO2,肯定有H2 | D. | 可能有CO2、NH3和水蒸气 |
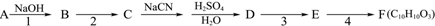
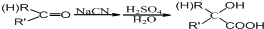
 .
.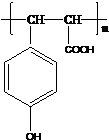 .
.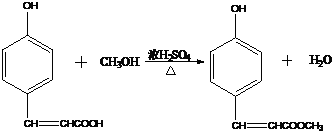 ,反应类型酯化反应.
,反应类型酯化反应. )
)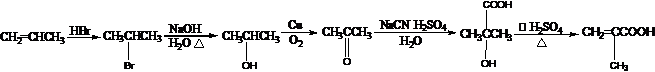 .
.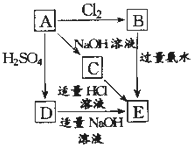 在如图式中,E是不溶于水的白色胶状物质,试推断:
在如图式中,E是不溶于水的白色胶状物质,试推断: