题目内容
16.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 14g聚丙烯中含C-H键总数目为2NA | |
| B. | 1molFe与足量的稀硝酸反应转移电子总数目为2NA | |
| C. | 标准状况下,44.8L乙醛中含乙醛分子总数目为2NA | |
| D. | 常温常压下,200g质量分数为17%H2O2溶液中含氧原子总数目为2NA |
分析 A.聚丙烯最简式为CH2,2个氢原子与碳分别形成1故C-H键,C-H键个数等于氢原子个数;
B.铁与足量硝酸反应生成三价铁离子;
C.标准状况下,乙醛为液体;
D.双氧水溶液中,过氧化氢、水分子都含有氧原子.
解答 解:A.14g聚丙烯的物质的量=$\frac{14}{14}$=1(mol),含有2mol氢原子,含C-H键总数目为2NA,故A正确;
B.1molFe与足量的稀硝酸反应生成硝酸铁,转移电子总数目为3NA,故B错误;
C.标准状况下,乙醛为液体,不能使用气体摩尔体积,故C错误;
D.双氧水溶液中,过氧化氢、水分子都含有氧原子,100g17%H2O2水溶液中含氧原子总数大于2NA,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的分析应用,主要考查气体摩尔体积条件分析应用,物质的量计算微粒数,氧化还原反应电子转移数目计算,注意铁与硝酸反应产物与硝酸的用量关系,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.在FeCl3和CuCl2的混合溶液中加入过量铁粉,反应完全后剩余固体的质量大于加入的铁粉质量.已知原混合溶液中FeCl3为0.4mol,则CuCl2的物质的量可能是( )
| A. | 0.2 mol | B. | 0.6 mol | C. | 1.2 mol | D. | 2 mol |
11.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 玻璃钢是钢与玻璃纤维形成的复合材料 | |
| B. | 氮氧化物是形成光化学烟雾和酸雨的一个重要原因 | |
| C. | 石油化工废弃物易造成水体富营养化 | |
| D. | 硫酸铵是常用的一种硝态氮肥 |
1.四氢大麻酚具有抗癌、抗菌等作用,其结构简式如图所示.下列说法不正确的是( )

| A. | 每个四氢大麻酚分子中含有3个手性碳原子 | |
| B. | 四氢大麻酚能与FeCl3溶液发生显色反应 | |
| C. | 1mol四氢大麻酚最多可与1molBr2发生加成反应 | |
| D. | 1mol四氢大麻酚与NaOH溶液反应,最多消耗2molNaOH |
8.如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法不正确的是( )


| A. | 离子半径:d3+<f- | |
| B. | 原子失电子能力:c>d | |
| C. | 最简单气态氢化物的热稳定性:a<e | |
| D. | b、c两元素可组成既含离子键又含共价键的化合物 |
5.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法不正确的是( )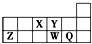

| A. | 离子半径的大小顺序为r(W2-)>r(Q-)>r(Y2-)>r(Z3+) | |
| B. | 元素W的最高价氧化物对应水化物的酸性比Q的强 | |
| C. | 元素X与Q的氢化物化合的产物中既含共价键又含离子键 | |
| D. | X、Z、W、Q四种元素的最高价氧化物对应的水化物均能与强碱反应 |



 ,B中的官能团名称是醛基、羟基.
,B中的官能团名称是醛基、羟基. .
. .
.

 .
. .
. ,反应类型酯化反应.
,反应类型酯化反应. )
) .
.