题目内容
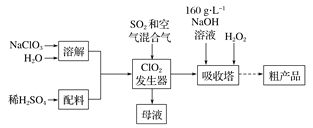
【题目】海水中含有80多种元素,是重要的物质资源宝库,同时海水具有强大的自然调节能力,为解决环境污染问题提供了广阔的空间。
(1)①已知不同pH条件下,水溶液中碳元素的存在形态如下图所示。

下列说法不正确的是_____________ (填字母序号)。
a. pH=8时,溶液中含碳元素的微粒主要是HCO3-
b. A点,溶液中H2CO3和HCO3-浓度相同
c. 当c(HCO3-)=c(CO32-)时,c(H+)>c(OH-)
②向上述pH=8.4的水溶液中加入NaOH溶液时发生反应的离子方程式是_____________。
(2)海水pH稳定在7.9~8.4之间,可用于烟道气中CO2和SO2的吸收剂。
①海水中含有的OH-可以吸收烟道气中的CO2,同时为海水脱钙,生产CaCO3。写出此反应的离子方程式:_____________。
②已知:25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10-11
H2SO3电离平衡常数K1=1.5×10-2 K2=6.0×10-8
海水中含有的HCO3-可用于吸收SO2,该过程产物中有CO2和_____________。
(3)洗涤烟气后的海水呈酸性,需处理后再行排放。与新鲜海水混合同时鼓入大量空气排出部分CO2,是一种处理的有效方式。
①通入O2可将酸性海水中的硫(IV)氧化,该反应的离子方程式是_____________。
②上述方式使处理后海水pH升高的原因是_____________。
【答案】bc HCO3-+OH-=CO32-+H2O CO2+2OH-+Ca2+=CaCO3↓+H2O HSO3- O2+2HSO3-=2SO42-+2H+ 碱性海水的中和及稀释作用,鼓入空气排除了部分CO2
【解析】
(1)①a.由图象分析可以知道,pH=8时溶液中含碳元素的微粒主要是HCO3-,故a正确;
b.A点是碳酸氢根离子物质的量分数与二氧化碳和碳酸分子物质的量分数相同,溶液中H2CO3和HCO3-浓度不相同,故b错误;
c.由图象分析可以知道当c(HCO3-)=c(CO32-)时,pH=10溶液显碱性,c(H+)<c(OH-),故c错误;
②pH=8.4的水溶液中主要是HCO3-,加入NaOH溶液时,反应为碳酸氢根离子和氢氧根离子反应生成碳酸根和水,反应的离子方程式为:HCO3-+OH-=CO32-+H2O;
(2)①海水中钙离子在碱溶液中和二氧化碳反应生成碳酸钙沉淀和水,反应离子方程式为:CO2+2OH-+Ca2+=CaCO3↓+H2O;
②25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10-11,H2SO3 电离平衡常数K1=1.5×10-2 K2=6.0×10-8,酸性强弱H2SO3> H2CO3> HSO3-> HCO3-,海水中含有的HCO3-可用于吸收SO2,反应生成二氧化碳和亚硫酸氢根离子;
(3)①洗涤烟气后的海水呈酸性是亚硫酸氢根离子电离大于其水解,通入O2可将酸性海水中的硫(IV)氧化生成硫酸根离子,反应的离子方程式为:O2+2HSO3-=2SO42-+2H+;
②上述方式使处理后海水pH升高的原因是与新鲜海水的中和以及混合的稀释作用,鼓入空气排除了部分CO2。据此解答。
(1)①a.由图象分析可以知道,pH=8时溶液中含碳元素的微粒主要是HCO3-,故a正确;
b.A点是碳酸氢根离子物质的量分数与二氧化碳和碳酸分子物质的量分数相同,溶液中H2CO3和HCO3-浓度不相同,故b错误;
c.由图象分析可以知道当c(HCO3-)=c(CO32-)时,pH=10溶液显碱性,c(H+)<c(OH-),故c错误。本小题答案为:bc。
②pH=8.4的水溶液中主要是HCO3-,加入NaOH溶液时,反应为碳酸氢根离子和氢氧根离子反应生成碳酸根和水,反应的离子方程式为:HCO3-+OH-=CO32-+H2O。本小题答案为:HCO3-+OH-=CO32-+H2O。
(2)①海水中钙离子在碱溶液中和二氧化碳反应生成碳酸钙沉淀和水,反应离子方程式为:CO2+2OH-+Ca2+=CaCO3↓+H2O。本小题答案为:CO2+2OH-+Ca2+=CaCO3↓+H2O。
②25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10-11,H2SO3 电离平衡常数K1=1.5×10-2 K2=6.0×10-8,酸性强弱H2SO3> H2CO3> HSO3-> HCO3-,海水中含有的HCO3-可用于吸收SO2,反应生成二氧化碳和亚硫酸氢根离子。本小题答案为:HSO3-。
(3)①洗涤烟气后的海水呈酸性是亚硫酸氢根离子电离大于其水解,通入O2可将酸性海水中的硫![]() 氧化生成硫酸根离子,反应的离子方程式为:O2+2HSO3-=2SO42-+2H+。本小题答案为:O2+2HSO3-=2SO42-+2H+。
氧化生成硫酸根离子,反应的离子方程式为:O2+2HSO3-=2SO42-+2H+。本小题答案为:O2+2HSO3-=2SO42-+2H+。
②上述方式使处理后海水pH升高的原因是与新鲜海水的中和以及混合的稀释作用,鼓入空气排除了部分CO2。本小题答案为:碱性海水的中和及稀释作用,鼓入空气排除了部分CO2。

【题目】钴被誉为战略物资,有出色的性能和广泛的应用.以水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、A12O3、MnO等)制取钴产品的工艺流程如下:

已知:
①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Mn(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)写出浸出过程、Co2O3发生反应的离子方程式:_________________________。
(2)写出NaC1O3发生反应的主要离子方程式:______________________________;
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为____________________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________________;萃取剂使用的最佳pH范围是__________(填代号)。
A.1.0~1.5 B.2.0~2.5 C.3.0~3.5 D.4.0~4.5

(5)“沉钴”时生成CoCO3的离子方程式为__________________________________。
(6)在空气中焙烧CoCO3生成CoxOy和CO2,测得充分煅烧后固体质量为4.82g,CO2的体积为1.344L(标准状况),则CoxOy的化学式为___________________。