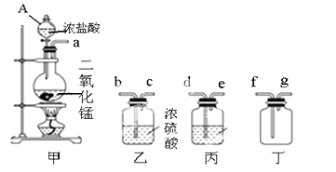
题目内容
【题目】钴被誉为战略物资,有出色的性能和广泛的应用.以水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、A12O3、MnO等)制取钴产品的工艺流程如下:

已知:
①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Mn(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)写出浸出过程、Co2O3发生反应的离子方程式:_________________________。
(2)写出NaC1O3发生反应的主要离子方程式:______________________________;
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为____________________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________________;萃取剂使用的最佳pH范围是__________(填代号)。
A.1.0~1.5 B.2.0~2.5 C.3.0~3.5 D.4.0~4.5

(5)“沉钴”时生成CoCO3的离子方程式为__________________________________。
(6)在空气中焙烧CoCO3生成CoxOy和CO2,测得充分煅烧后固体质量为4.82g,CO2的体积为1.344L(标准状况),则CoxOy的化学式为___________________。
【答案】Co2O3+SO32-+4H+=2Co2++SO42-+2H2O ClO3-+6Fe2++6H+= Cl-+6Fe3++3H2O Fe(OH)3、Al(OH)3 除去滤液中的Mn2+ C Co2++2HCO3-=CoCO3↓+H2O+CO2↑ Co3O4
【解析】
含钴废料中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2,加入NaClO3,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2,向该溶液中加入萃取剂分离出Mn2+,然后加入NH4HCO3溶液得到CoCO3沉淀。
(1)水钴矿进行预处理时,Na2SO3是还原剂,还原Co3+;
(2)NaClO3的作用是将Fe2+氧化成Fe3+;
(3) 加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀;
(4)根据不同的pH对金属阳离子Mn2+、Co2+的萃取率的不同选择;
(5)利用复分解反应得到反应的方程式;
(6)计算二氧化碳物质的量,根据CoCO3的化学式可以确定Co原子数目,再根据CoxOy的质量确定O原子物质的量,计算Co、O原子数目之比确定化学式。
(1)水钴矿用HCl、Na2SO3进行预处理时,Na2SO3是还原剂,还原Co3+为Co2+,反应的离子方程式为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;
(2)NaClO3的作用是将Fe2+氧化成Fe3+,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
(3)加Na2CO3调pH至5.2时,Al3+能与CO32-发生双水解生成Al(OH)3沉淀和CO2气体;Fe3+能与CO32-离子发生双水解生成Fe(OH)3沉淀和CO2气体,所以沉淀成分为:Fe(OH)3、Al(OH)3;
(4)Al3+、Fe3+形成Fe(OH)3、Al Fe(OH)3沉淀析出,根据流程图可知,此时溶液中存在Mn2+、Co2+离子,加入萃取剂调节溶液的pH至3.0~3.5时就可以将Mn2+萃取出来,剩余的溶液中含有Co2+离子;
(5)向含有Co2+的溶液中加入NH4HCO3,发生复分解反应,得到CoCO3沉淀,反应的离子方程式为Co2++2HCO3-=CoCO3↓+H2O+CO2↑;
(6) 在空气中焙烧CoCO3生成CoxOy和CO2,产生CO2的物质的量为n(CO2)=1.344L÷22.4L/mol=0.06mol,由Co、C原子比例关系,可知Co原子物质的量为0.06mol,则CoxOy中O原子物质的量为n(O)=![]() =0.08mol,故CoxOy中Co、O原子数目之比=0.06mol:0.08mol=3:4,则CoxOy的化学式为Co3O4。
=0.08mol,故CoxOy中Co、O原子数目之比=0.06mol:0.08mol=3:4,则CoxOy的化学式为Co3O4。

 阅读快车系列答案
阅读快车系列答案【题目】下表中相关物质的信息都正确的一项是
选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
A | NaClO | 离子键、共价键 | 强氧化性 | 消毒液 |
B | H2O2 |
| 不稳定,易分解 | 医用消毒剂 |
C | NH3 | 共价键 | 水溶液呈弱碱性 | 工业制硝酸 |
D | NaHCO3 | 离子键 | 受热易分解 | 泡沫灭火器 |
A. A B. B C. C D. D