题目内容
【题目】设pC为溶液中粒子物质的量浓度的负对数,即:pC=-lgC。25℃时,某浓度H2R水溶液中,pC(H2R)、pC(HR-)、pC(R2-)随溶液pH的变化曲线如图所示。下列说法正确的是
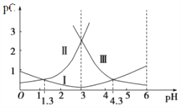
A. 曲线I表明,c(R2-)随着pH增大而逐渐增大
B. pH=1.3时,3c(R2-)+c(OH-)=10-1.3mol/L
C. 常温下,该体系中c2(HR-)/ c(R2-)·c(H2R)=1000
D. NaHR水溶液中:c(Na+)>c(HR-)>c(OH-)>c(H+)
【答案】C
【解析】分析:H2R![]() H++HR-, HR-
H++HR-, HR-![]() H++R2-,随pH增大电离平衡正向移动,c(H2R),开始较大,后逐渐减小,c(HR-)先增大后减小,c(R2-)开始较小,后逐渐增大,pC为溶液中粒子物质的量浓度的负对数,C越大pC越小,由图像可知:曲线I是pC(HR-)随溶液pH的变化曲线,曲线II是pC(H2R)随溶液pH的变化曲线,曲线III是pC(R2-)随溶液pH的变化曲线;
H++R2-,随pH增大电离平衡正向移动,c(H2R),开始较大,后逐渐减小,c(HR-)先增大后减小,c(R2-)开始较小,后逐渐增大,pC为溶液中粒子物质的量浓度的负对数,C越大pC越小,由图像可知:曲线I是pC(HR-)随溶液pH的变化曲线,曲线II是pC(H2R)随溶液pH的变化曲线,曲线III是pC(R2-)随溶液pH的变化曲线;
详解:A. 从以上分析可知,曲线III表明,c(R2-)随着pH增大而逐渐增大,故A错误;B. pH=1.3时,c(HR-)= c(H2R),根据电荷守恒c(HR-)+2c(R2-)+c(OH-)=c(H+)=10-1.3mol/L
由于c(HR-)> c(R2-),所以3c(R2-)+c(OH-)<10-1.3mol/L,故B错误;C. 常温下,该体系中c2(HR-)/ c(R2-)·c(H2R)=![]() =
=![]() =
=![]() =
=![]() =1000,故C正确;D. pH=1.3时,c(HR-)= c(H2R),Ka1=
=1000,故C正确;D. pH=1.3时,c(HR-)= c(H2R),Ka1=![]() =c(H+)=10-1.3,pH=4.3时,c(HR-)= c(R2-),Ka2=
=c(H+)=10-1.3,pH=4.3时,c(HR-)= c(R2-),Ka2=![]() =c(H+)=10-4.3,NaHR的水解常数Kh=
=c(H+)=10-4.3,NaHR的水解常数Kh=![]() =
=![]() =10-12.7,因此,NaHR水解小于电离,溶液显酸性,c(OH-)<c(H+),故D错误;因此,本题正确答案为C。
=10-12.7,因此,NaHR水解小于电离,溶液显酸性,c(OH-)<c(H+),故D错误;因此,本题正确答案为C。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】O2、O3、N2、N4是氧和氮元素的几种单质。回答下列问题:
(1)O原子中价电子占据的轨道数目为__________________。
(2)第一电离能I1:N____O(填“>”或“<”),第二电离能I2:O大于N的原因是__________________。
(3)O3的空间构型为_________________;是_____________(填“极性”或“非极性”)分子;分子中存在的大π键,可用符号![]() 表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为_______________________。
表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为_______________________。
(4)N元素的简单气态氢化物NH3在H2O中溶解度很大,其原因之一是NH3和H2O可以形成分子间氢键,则在氨水中氢键可以表示为H3N…H-N、___________、____________ (任写两种即可)。
(5)已知:如下键能和键长数目。
化学键 | 键长/pm | 键能/ |
N-N | 145 | 193 |
N=N | 125 | 418 |
N | 110 | 946 |
N2和N4都是N元素的单质,其中N4是正面体构型,N原子占据四面体的四个顶点,从键参数角度分析N4分子稳定性远小于N2原因是________________________________________。
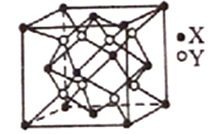
(6)Na2O的晶胞结构如下图所示,X表示O2-,Y表示Na+,则O2-的配位数为_______________,该晶胞的原子空间利用率为_______________;(已知该晶胞的棱长为apm,r(Na+)=xpm,r(O2-)=ypm)。
【题目】铋(Bi)与氮同族,氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色、生产金属铋等。一种以用火法炼铜过程产生的铜转炉烟尘(除含铋的化合物之外,还有CuSO4、ZnSO4、CuS、Fe2O3、PbSO4及As2O3)制备高纯氯氧化铋的工艺流程如下:

请回答:
(1)BiOCl中Bi元素的化合价为__________。
(2)向“酸浸”所得“浸液1”中加入Zn粉,主要目的是__________________________。
(3)“浸铜”时,有单质硫生成,其反应的离子方程式为____________________________。
(4)“浸铋”时,温度升高,铋的浸出率降低,其原因为____________________________。
(5)“沉铋”时需控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为__________。
(6)“除铅、砷”时,可以采用以下两种方法:
①加入改性羟基磷灰石固体(HAP):浸液2与HAP的液固比(L/S)与铅、砷去除率以及后续沉铋量的关系如下表:
L/S | 125∶1 | 50∶1 | 25∶1 | 15∶1 |
Pb2+去除率/% | 84.86 | 94.15 | 95.40 | 96.83 |
As3+去除率/% | 98.79 | 98.92 | 98.34 | 99.05 |
m(沉铋)/g | 2.34 | 2.33 | 2.05 | 1.98 |
实验中应采用的L/S=__________。
②铁盐氧化法:向浸液2中加入Fe2(SO4)3,并调节pH,生成FeAsO4沉淀。当溶液中c(AsO43-)=1×10-9mol/L,且不产生Fe(OH)3沉淀,此时溶液的pH为__________。(已知:1g2=0.3;FeAsO4、Fe(OH)3的Ksp分别为5×10-21、4×10-38。)