题目内容
【题目】通常工业上监测SO2含量是否达到排放标准的化学反应原理是:SO2 + H2O2 + BaCl2 ![]() BaSO4↓+ 2HCl。用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
BaSO4↓+ 2HCl。用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A. 0.1 mol BaCl2固体中所含离子总数为0.3 NA
B. 25 oC时,pH=1的HCl溶液中含有H+的数目约为0.1 NA
C. 标准状况下,17 g H2O2中所含共用电子对数为2 NA
D. 生成2.33 g BaSO4沉淀时,吸收SO2的体积为0.224 L
【答案】A
【解析】A. 1molBaCl2固体中含有1mol钡离子和2mol氯离子,离子总数为3mol,则0.1 mol BaCl2固体中所含离子总数为0.3 NA,故A正确;B. 因溶液的体积未知,所以无法计算HCl溶液中含有的氢离子数目,故B错误;C. 17 g H2O2的物质的量为17g÷34g/mol=0.5mol,H2O2的电子式为:![]() ,由电子式可知,1molH2O2中含有3mol共用电子对,则0.5molH2O2中含有1.5mol共用电子对,数目为1.5NA,故C错误;D. 因未说明气体是否处于标准状况,所以无法计算吸收SO2的体积,故D错误;答案选A。
,由电子式可知,1molH2O2中含有3mol共用电子对,则0.5molH2O2中含有1.5mol共用电子对,数目为1.5NA,故C错误;D. 因未说明气体是否处于标准状况,所以无法计算吸收SO2的体积,故D错误;答案选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】下图是用点滴板探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板。下列对实验现象的解释正确的是( )
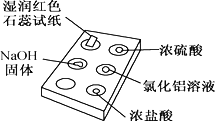
选项 | 实验现象 | 解释 |
A | 红色石蕊试纸变蓝 | NH3极易溶于水 |
B | 浓硫酸附近无白烟 | NH3与浓硫酸不发生反应 |
C | 氯化铝溶液变浑浊 | NH3与AlCl3溶液反应:Al3++3OH-=Al(OH)3↓ |
D | 浓盐酸附近有白烟 | NH3与挥发出的HCl反应:NH3+HCl=NH4Cl |
A. A B. B C. C D. D




