题目内容
【题目】O2、O3、N2、N4是氧和氮元素的几种单质。回答下列问题:
(1)O原子中价电子占据的轨道数目为__________________。
(2)第一电离能I1:N____O(填“>”或“<”),第二电离能I2:O大于N的原因是__________________。
(3)O3的空间构型为_________________;是_____________(填“极性”或“非极性”)分子;分子中存在的大π键,可用符号![]() 表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为_______________________。
表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为_______________________。
(4)N元素的简单气态氢化物NH3在H2O中溶解度很大,其原因之一是NH3和H2O可以形成分子间氢键,则在氨水中氢键可以表示为H3N…H-N、___________、____________ (任写两种即可)。
(5)已知:如下键能和键长数目。
化学键 | 键长/pm | 键能/ |
N-N | 145 | 193 |
N=N | 125 | 418 |
N | 110 | 946 |
N2和N4都是N元素的单质,其中N4是正面体构型,N原子占据四面体的四个顶点,从键参数角度分析N4分子稳定性远小于N2原因是________________________________________。
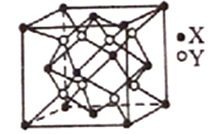
(6)Na2O的晶胞结构如下图所示,X表示O2-,Y表示Na+,则O2-的配位数为_______________,该晶胞的原子空间利用率为_______________;(已知该晶胞的棱长为apm,r(Na+)=xpm,r(O2-)=ypm)。
【答案】 4 > 失去一个电子后O+的2p处于半充满状态,更加稳定,再失去一个电子消耗能量更高 V形 极性 ![]() H3N…H-O、H2O…H-N H2O…H-O N4中N-N键能小于N2中的N
H3N…H-O、H2O…H-N H2O…H-O N4中N-N键能小于N2中的N![]() N,键长大于N
N,键长大于N![]() N 8
N 8 ![]() ×100%
×100%
【解析】分析:(1)根据原子核外电子排布式及一个原子轨道最多容纳2个电子解答。
(2)电离能是基态的气态原子失去电子变为气态阳离子,必须克服核电荷对电子的引力而所需要的能量;第一电离能是原子失去一个电子,而第二电离能则是失去外层第二个电子;可根据元素性质(活泼性)判断。
(3)臭氧中O原子以sp2杂化轨道形成σ键,分子形状为V形,形成三中心四电子大π键。
(4)N原子与其他分子的H原子之间可形成分子间氢键,O原子与其他分子的H原子之间也可形成分子间氢键。
(5)键长越小,说明原子核之间的距离小,键能越大,拆开化学键需要的能量高,稳定性越高,由此入手分析。
(6)结合晶胞结构,以处于面心上的O2-周围Na+数为例分析O2-的配位数比较容易理解;先计算晶胞中的微粒的体积,再计算晶胞体积,二者的体积百分比即是空间利用率。
详解:(1)O原子的价电子排布式为2s22p4,其价电子占据的4原子轨道。
(2)同周期从左到右第一电离能呈增大趋势,但N的电子排布最外层p能级三个轨道各有一电子,处于半充满状态,比较稳定,所以第一电离能I1:N>O;O失去一个电子后O+的2p处于半充满状态,更加稳定,再失去一个电子消耗能量更高,所以第二电离能I2:O>N。
(3)O3看成一个O原子是中心原子,其他两个O原子为配原子的三原子分子,价电子对数=2+1/2(6-2×2)=3,有一个孤电子对,属于sp2杂化,空间构型为V形;因为V形空间构型正负电荷重心不重合,所以是极性分子;O原子的轨道表示式为:![]() ,O3中心氧原子采取sp2杂化,其中两个单电子轨道与另外两个原子形成两个σ键,第三个轨道有一对孤电子对,与另两个氧原子的各1个电子形成三中心四电子大π键,可用符号
,O3中心氧原子采取sp2杂化,其中两个单电子轨道与另外两个原子形成两个σ键,第三个轨道有一对孤电子对,与另两个氧原子的各1个电子形成三中心四电子大π键,可用符号![]() 表示。
表示。
(4)因为O、N原子有比较强的吸电子能力,所以NH3和H2O既会吸引同种分子的H,又会吸引对方分子的H,从而形成氢键,所以在氨水中存在4种分子间氢键,可以表示为:H3N…H-N、H3N…H-O、H2O…H-N、H2O…H-O。
(5)因为N4是正面体构型,N原子占据四面体的四个顶点,所以N4中只存在N-N,而N2中只存在N![]() N,由表中数据可知,N-N键长大于N
N,由表中数据可知,N-N键长大于N![]() N键长,N-N键能小于N
N键长,N-N键能小于N![]() N键能,且二者键能差距较大,所以N4分子稳定性远小于N2。
N键能,且二者键能差距较大,所以N4分子稳定性远小于N2。
(6)分析Na2O的晶胞结构图可得,处于面心上的O2-被2个晶胞共用,以图中上面的面心O2-为例,在其上方还有一个同样的晶胞与其紧邻,所以每个O2-周围有8个Na+与之最近距离,则O2-的配位数为8;Na2O晶胞中Na+数为8,O2-数为:8×![]() +6×
+6×![]() =4,根据r(Na+)=xpm、r(O2-)=ypm及球体的体积公式可得:这12个原子总体积V1=8×
=4,根据r(Na+)=xpm、r(O2-)=ypm及球体的体积公式可得:这12个原子总体积V1=8×![]() ×πx+4×
×πx+4×![]() ×πy,根据该晶胞的棱长为apm,则晶胞体积为:V2=a3,所以该晶胞的原子空间利用率为:V1÷V2×100%=(8×
×πy,根据该晶胞的棱长为apm,则晶胞体积为:V2=a3,所以该晶胞的原子空间利用率为:V1÷V2×100%=(8×![]() ×πx+4×
×πx+4×![]() ×πy)÷a3×100%=
×πy)÷a3×100%=![]() ×100%。
×100%。

【题目】三氯氧磷(POCl3)常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
Ⅰ.制备POCl3。
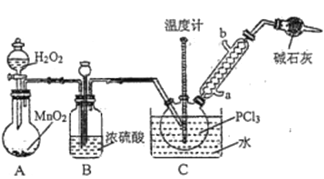
采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图所示:
已知:①Ag++SCN-=AgSCN↓;Ksp(AgCl)>Ksp(AgSCN);磷酸银溶于硝酸。
②PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)POCl3遇水反应的化学方程式为_________________________________________。
(2)装置B的作用除干燥O2外,还有_________________________________________。干燥管的作用是_______________。
(3)反应温度要控制在60~65℃,原因是_____________________________________________。
Ⅱ.测定POCl3产品的含量。
实验步骤:
①制备POCl3实验结束后,待三颈烧瓶中的液体冷却至室温,准确称取30.7gPOCl3产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液。
②取10.00mL溶液于锥形瓶中,加入10.00mL3.2mol/LAgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2mol/LKSCN溶液漓定过量的AgNO3溶液,达到滴定终点时共用去10.00mLKSCN溶液。
(4)步骤③中加入硝基苯的作用是___________________________________________。若无此操作,所测产品中氯元素的质量分数将会__________(填“偏大”、“偏小”或“不变”)。
(5)步骤④中X为__________,产品中POCl3的质量分数为____________。