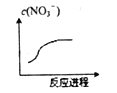
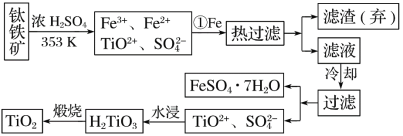
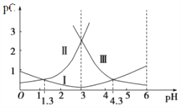
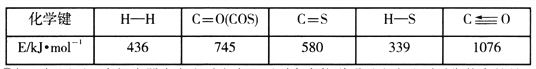
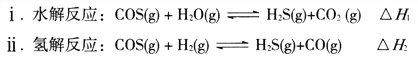题目内容
【题目】铋(Bi)与氮同族,氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色、生产金属铋等。一种以用火法炼铜过程产生的铜转炉烟尘(除含铋的化合物之外,还有CuSO4、ZnSO4、CuS、Fe2O3、PbSO4及As2O3)制备高纯氯氧化铋的工艺流程如下:

请回答:
(1)BiOCl中Bi元素的化合价为__________。
(2)向“酸浸”所得“浸液1”中加入Zn粉,主要目的是__________________________。
(3)“浸铜”时,有单质硫生成,其反应的离子方程式为____________________________。
(4)“浸铋”时,温度升高,铋的浸出率降低,其原因为____________________________。
(5)“沉铋”时需控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为__________。
(6)“除铅、砷”时,可以采用以下两种方法:
①加入改性羟基磷灰石固体(HAP):浸液2与HAP的液固比(L/S)与铅、砷去除率以及后续沉铋量的关系如下表:
L/S | 125∶1 | 50∶1 | 25∶1 | 15∶1 |
Pb2+去除率/% | 84.86 | 94.15 | 95.40 | 96.83 |
As3+去除率/% | 98.79 | 98.92 | 98.34 | 99.05 |
m(沉铋)/g | 2.34 | 2.33 | 2.05 | 1.98 |
实验中应采用的L/S=__________。
②铁盐氧化法:向浸液2中加入Fe2(SO4)3,并调节pH,生成FeAsO4沉淀。当溶液中c(AsO43-)=1×10-9mol/L,且不产生Fe(OH)3沉淀,此时溶液的pH为__________。(已知:1g2=0.3;FeAsO4、Fe(OH)3的Ksp分别为5×10-21、4×10-38。)
【答案】 +3 除去Cu2+、Fe3+ CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O 温度升高,盐酸挥发,反应物浓度降低 BiCl3+Na2CO3=BiOCl↓+2NaCl+CO2↑ 50∶1 5.3
【解析】(1)BiOCl中O为-2价,Cl为-1价,根据化合价代数和为0,可知Bi元素的化合价为+3价,答案为:+3
(2)向“酸浸”所得“浸液1”中加入Zn粉,Zn粉能与Cu2+、Fe3+反应生成Cu和Fe,从而除去Cu2+、Fe3+,答案为:除去Cu2+、Fe3+
(3) “浸铜”时,加入的物质是稀硫酸、MnO2,得到单质硫,发生反应CuS+MnO2+H+→Cu2++Mn2++S↓+H2O,根据化合价升降法配平,离子方程式为:CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O,答案为:CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O
(4)“浸铋”时,所加物质为盐酸和氯化钠溶液,盐酸易挥发,升高温度,HCl挥发,反应物浓度降低,答案为:温度升高,盐酸挥发,反应物浓度降低
(5) “沉铋”时加入的物质是Na2CO3,生成BiOCl,因此有BiCl3+Na2CO3→BiOCl,根据发应特点产物还有NaCl和CO2,化学方程式为:BiCl3+Na2CO3=BiOCl↓+2NaCl+CO2↑答案为:BiCl3+Na2CO3=BiOCl↓+2NaCl+CO2↑
(6)①根据表格数据,L/S=50:1以后,Pb2+、As3+去除率虽然增加,但是Pb2+、As3+去除率变化都不大,因此为了节省能源以及原料,L/S控制在50:1②c(AsO43-)=1×10-9mol/L,此时c(Fe3+)=Ksp(FeAsO4)/c(AsO43-)=5×10-21/10-9mol/L=5×10-12mol/L,此时c(OH-)=![]() =
=![]() =2×10-9 mol/L,此时的pH=5.3,即pH小于5.3.答案为:5.3
=2×10-9 mol/L,此时的pH=5.3,即pH小于5.3.答案为:5.3

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】三氯氧磷(POCl3)常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
Ⅰ.制备POCl3。
采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图所示:
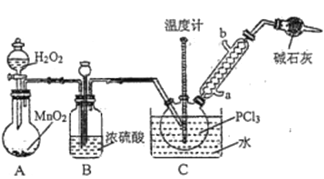
已知:①Ag++SCN-=AgSCN↓;Ksp(AgCl)>Ksp(AgSCN);磷酸银溶于硝酸。
②PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)POCl3遇水反应的化学方程式为_________________________________________。
(2)装置B的作用除干燥O2外,还有_________________________________________。干燥管的作用是_______________。
(3)反应温度要控制在60~65℃,原因是_____________________________________________。
Ⅱ.测定POCl3产品的含量。
实验步骤:
①制备POCl3实验结束后,待三颈烧瓶中的液体冷却至室温,准确称取30.7gPOCl3产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液。
②取10.00mL溶液于锥形瓶中,加入10.00mL3.2mol/LAgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2mol/LKSCN溶液漓定过量的AgNO3溶液,达到滴定终点时共用去10.00mLKSCN溶液。
(4)步骤③中加入硝基苯的作用是___________________________________________。若无此操作,所测产品中氯元素的质量分数将会__________(填“偏大”、“偏小”或“不变”)。
(5)步骤④中X为__________,产品中POCl3的质量分数为____________。