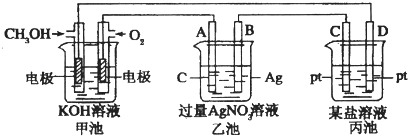
题目内容
【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化对环境保护具有重要意义.
(1)SO2的大量排放会引起严重的环境问题是 , 潮湿条件下,写出大气中SO2转化为HSO3﹣的方程式 .
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42﹣ , 两步反应的能量变化示意图1如下:
1mol H2S(g)全部氧化成SO42﹣(aq)的热化学方程式为
(3)SO2是工业制硫酸的原料气体之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2 , 发生反应:2SO2(g)+O2(g)2SO3(g),过程中测定的部分数据见表:
时间/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.050 |
4 | 0.050 | 0.025 |
5 | 0.040 | |
8 | 0.020 |
①反应在0~4min内的平均速率为v(SO2)=;
②此温度下该反应的化学平衡常数K= ,
③8min时,维持温度不变,往反应容器中再通入0.020mol SO2(g),0.010mol O2(g),重新达到平衡时混合气体中SO2的百分含量将(填“减小”,“增大”或“不变”).(4)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:
①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有 .
②一般来说,如果一个反应的平衡常数大于105 , 通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10﹣5 , 则认为这个反应很难进行.已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10﹣36;H2S:K a1=1.3×10﹣7 , K a2=7.1×10﹣15 ,
通过计算说明反应CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq)进行的程度 . 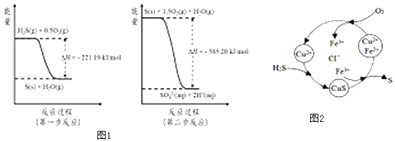
【答案】
(1)酸雨;SO2+H2O?H2SO3;H2SO3?H++HSO3﹣
(2)H2S(g)+2O2(g)=SO42﹣(aq)+2H+(aq)△H=﹣806.39kJ?mol﹣1
(3)6.25×10﹣3mol/(L?min);225(mol/L);减小;通入足量的空气;反应很难进行
【解析】解:(1)SO2的大量排放会引起严重的环境问题是形成酸雨,二氧化硫为酸性氧化物与水生成亚硫酸,亚硫酸为弱电解质,部分电离产生氢离子与亚硫酸氢根离子,离子方程式:SO2+H2OH2SO3;H2SO3H++HSO3﹣ ,
所以答案是:酸雨;SO2+H2OH2SO3;H2SO3H++HSO3﹣;(2)由图可知,第一步热化学反应为:H2S(g)+0.5O2(g)=S(s)+H2O(g)△H=﹣221.19 kJmol﹣1;
第二步反应为:S(s)+1.5O2(g)+H2O(g)=2H+(aq)+SO42﹣(aq))△H=﹣585.20 kJmol﹣1;
依据盖斯定律,第一步与第二步方程式相加得:H2S(g)+2O2(g)=SO42﹣(aq)+2H+(aq)△H=﹣806.39 kJmol﹣1;
所以答案是:H2S(g)+2O2(g)=SO42﹣(aq)+2H+(aq)△H=﹣806.39 kJmol﹣1 ;(3)①0﹣4min二氧化硫物质的量变化为0.10mol﹣0.050mol=0.050mol,反应速率v= ![]() =6.25×10﹣3mol/(Lmin),所以答案是:6.25×10﹣3mol/(Lmin);
=6.25×10﹣3mol/(Lmin),所以答案是:6.25×10﹣3mol/(Lmin);
②结合图表数据,5min时n(O2)= ![]() =0.03mol,剩余氧气物质的量=0.05mol﹣0.03mol=0.02mol,6min时氧气物质的量为0.02mol,说明5分钟反应达到平衡状态,结合化学平衡三行计算列式计算平衡浓度,5min时,
=0.03mol,剩余氧气物质的量=0.05mol﹣0.03mol=0.02mol,6min时氧气物质的量为0.02mol,说明5分钟反应达到平衡状态,结合化学平衡三行计算列式计算平衡浓度,5min时,
2SO2(g)+ | O2(g) | 2SO3(g) | ||
起始量(mol) | 0.1 | 0.05 | 0 | |
变化量(mol) | 0.06 | 0.03 | 0.06 | |
平衡量(mol) | 0.04 | 0.02 | 0.06 |
平衡常数= ![]() =
= 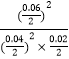 =225(mol/L)
=225(mol/L)
所以答案是:225(mol/L);
③8min时,维持温度不变,往反应容器中再通入0.020mol SO2(g),0.010mol O2(g),Qc= 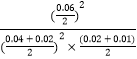 =
= ![]() =66.67<K,反应正向进行,平衡移动程度小重新达到平衡时混合气体中SO2的百分含量将减小,所以答案是:减小;(4)①使生成的硫单质中不含CuS,则硫离子不能有剩余,硫离子完全被氧化为硫单质,所以氧气必须过量,采取的措施是:增大混合气体中空气的比例,通入足量的空气,
=66.67<K,反应正向进行,平衡移动程度小重新达到平衡时混合气体中SO2的百分含量将减小,所以答案是:减小;(4)①使生成的硫单质中不含CuS,则硫离子不能有剩余,硫离子完全被氧化为硫单质,所以氧气必须过量,采取的措施是:增大混合气体中空气的比例,通入足量的空气,
所以答案是:通入足量的空气;②反应CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq),反应的平衡常数K= ![]() =
= ![]() =
= ![]() =
= ![]() =6.83×10﹣15<10﹣5 , 反应很难进行,
=6.83×10﹣15<10﹣5 , 反应很难进行,
所以答案是:反应很难进行;

【题目】用0.1032molL﹣1 HCl溶液滴定未知浓度的NaOH溶液,
(1)某同学按下列步骤进行实验:①取一锥形瓶,用待测NaOH溶液润洗两次; ②在锥形瓶中加入25.00 mL待测NaOH溶液;③加入几滴石蕊试剂做指示剂;④取一支酸式滴定管,洗涤干净; ⑤直接往酸式滴定管中注入标准酸溶液,进行滴定; ⑥两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点. 其中所述操作有错误的序号为
(2)取用25.00 mL待测NaOH溶液应用以下(选填:“甲”、“乙”)装置,若取用NaOH溶液开始平视读数、结束时俯视读数,会导致所测氢氧化钠溶液浓度(填“偏大““偏小“或“不变“) ![]()
(3)若滴定开始前滴定管尖嘴中有一气泡,滴定结束后气泡消失, 则会导致所测氢氧化钠溶液浓度(填“偏大““偏小“或“不变“)
(4)若平行实验三次,记录的数据如下表
滴定次数 | 待测溶液的体积(/mL) | 标准HCl溶液的体积 | |
滴定前读数(/mL) | 滴定后读数(/mL) | ||
1 | 25.00 | 1.02 | 21.04 |
2 | 25.00 | 2.00 | 22.98 |
3 | 25.00 | 0.20 | 20.18 |
试计算待测NaOH溶液的物质的量浓度(列出计算过程).