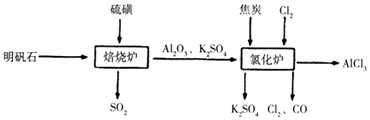
题目内容
【题目】下列物质属于同系物的是( )
A.![]() 和
和 ![]()
B.CH3CH2Cl和CH2ClCH2CH2Cl
C.C2H5OH和CH4O
D.CH3COOH和C17H33COOH
【答案】C
【解析】解:A. ![]() 为苯酚,而
为苯酚,而 ![]() 为苯甲醇,二者结构不同,一定不属于同系物,故A错误;
为苯甲醇,二者结构不同,一定不属于同系物,故A错误;
B.CH3CH2Cl和CH2ClCH2CH2Cl分别为烷烃的一氯代物、二氯代物,二者结构不相似,不属于同系物,故B错误;
C.C2H5OH和CH4O,二者都是饱和一元醇,二者结构相似,分子间相差1个CH2原子团,所以二者 互为同系物,故C正确;
D.CH3COOH为饱和一元羧酸,烃基中不存在碳碳双键,而C17H33COOH的烃基中含有碳碳双键,二者结构不同,一定不属于同系物,故D错误;
故选C.
【考点精析】通过灵活运用芳香烃、烃基和同系物,掌握分子里含有一个或多个苯环的碳氢化合物,称为芳香烃,其中由一个苯环和饱和烃基组成的芳香烃叫苯的同系物,其通式为CnH2n–6(n≥6)即可以解答此题.

【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化对环境保护具有重要意义.
(1)SO2的大量排放会引起严重的环境问题是 , 潮湿条件下,写出大气中SO2转化为HSO3﹣的方程式 .
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42﹣ , 两步反应的能量变化示意图1如下:
1mol H2S(g)全部氧化成SO42﹣(aq)的热化学方程式为
(3)SO2是工业制硫酸的原料气体之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2 , 发生反应:2SO2(g)+O2(g)2SO3(g),过程中测定的部分数据见表:
时间/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.050 |
4 | 0.050 | 0.025 |
5 | 0.040 | |
8 | 0.020 |
①反应在0~4min内的平均速率为v(SO2)=;
②此温度下该反应的化学平衡常数K= ,
③8min时,维持温度不变,往反应容器中再通入0.020mol SO2(g),0.010mol O2(g),重新达到平衡时混合气体中SO2的百分含量将(填“减小”,“增大”或“不变”).(4)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:
①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有 .
②一般来说,如果一个反应的平衡常数大于105 , 通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10﹣5 , 则认为这个反应很难进行.已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10﹣36;H2S:K a1=1.3×10﹣7 , K a2=7.1×10﹣15 ,
通过计算说明反应CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq)进行的程度 . 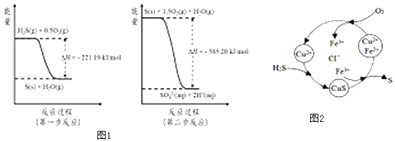
【题目】已知:乙二酸俗称草酸(结构简式为HOOC—COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.5×10-7,K2= 4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)相同条件下等物质的量浓度的Na2C2O4溶液的pH比Na2CO3溶液的pH_____ (填“大”、“小”或“相等”);
(2)常温下将20 mL 0.4 mol/L的KOH溶液与20 mL 0.2 mol/L的草酸溶液混合,则混合后溶液中阴离子浓度的大小顺序为_______________________;
(3)25℃时向20 mL碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol/L的草酸钾溶液20 mL,能否产生沉淀________(填“能”或“不能”).
(4)酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000molL-1酸性KMnO4标准溶液滴定未知浓度的草酸。
①高锰酸钾溶液常用______(填“稀硫酸”、“稀硝酸”、“稀盐酸”)酸化,写出滴定过程中发生反应的离子方程式 _____________________________。
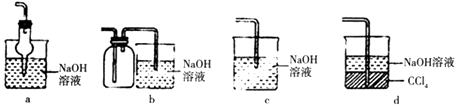
②滴定过程中操作滴定管的图示正确的是 ______________(填编号)。
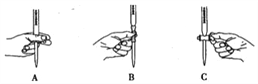
①判断滴定终点的方法是:_________________________________________。
②若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度________(填“偏高”或“偏低”或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1 。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
实验编号 | 温 度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究 b.实验1 和3 探究反应物浓度对该反应速率的影响; c.实验1 和4 探究催化剂对该反应速率的影响。 | |
体积(mL) | 浓度 (molL-1) | ||||
1 | 25 | 0.5 | 4 | 0.1000 | |
2 | 50 | 0.5 | 4 | 0.1000 | |
3 | 25 | 0.5 | 4 | 0.0100 | |
4 | 25 | 0 | 4 | 0.1000 | |
①写出表中a 对应的实验目的_______________________;
②该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验编号 | 溶液褪色所需时间(min) | ||
第1 次 | 第2 次 | 第3 次 | |
1 | 14.0 | 13.0 | 11.0 |
3 | 6.5 | 6.7 | 6.8 |
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。某同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述改进的实验方案________。