题目内容
【题目】室温时,0.1mol/L某一元酸HA的水溶液PH=4.下列描述不正确的是( )
A.该溶液中HA有0.1%发生了电离
B.此酸电离平衡常数约为10﹣7
C.升高温度后溶液的PH增大
D.若将PH=2的HA溶液与PH=12的NaOH溶液等体积混合后PH=7
【答案】CD
【解析】解:A.0.1mol/L某一元酸HA,pH=4,HA电离度为 ![]() =0.1%,故A正确; B.由HA═H++Ac﹣ , c(H+)=c(Ac﹣)=10﹣4mol/L,则电离平衡常数为
=0.1%,故A正确; B.由HA═H++Ac﹣ , c(H+)=c(Ac﹣)=10﹣4mol/L,则电离平衡常数为 ![]() =1×10﹣7 , 故B正确;
=1×10﹣7 , 故B正确;
C.温度升高促进电离,氢离子浓度变大,pH减小,故C错误;
D.HA是弱酸,未完全电离,故pH=2的HA的酸和pH=12的NaOH溶液混合后,HA过量,故混合后溶液显酸性,即pH小于7,故D错误.
故选CD.
A.利用PH=4,计算电离度;
B.根据电离度及离子的浓度计算电离平衡常数;
C.温度升高促进电离,氢离子浓度变大;
D.HA是弱酸,不能完全电离.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】研究大气中含硫化合物(主要是SO2和H2S)的转化对环境保护具有重要意义.
(1)SO2的大量排放会引起严重的环境问题是 , 潮湿条件下,写出大气中SO2转化为HSO3﹣的方程式 .
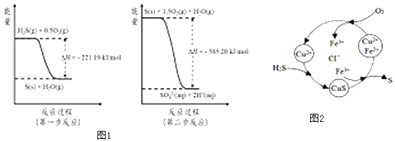
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42﹣ , 两步反应的能量变化示意图1如下:
1mol H2S(g)全部氧化成SO42﹣(aq)的热化学方程式为
(3)SO2是工业制硫酸的原料气体之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2 , 发生反应:2SO2(g)+O2(g)2SO3(g),过程中测定的部分数据见表:
时间/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.050 |
4 | 0.050 | 0.025 |
5 | 0.040 | |
8 | 0.020 |
①反应在0~4min内的平均速率为v(SO2)=;
②此温度下该反应的化学平衡常数K= ,
③8min时,维持温度不变,往反应容器中再通入0.020mol SO2(g),0.010mol O2(g),重新达到平衡时混合气体中SO2的百分含量将(填“减小”,“增大”或“不变”).(4)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:
①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有 .
②一般来说,如果一个反应的平衡常数大于105 , 通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10﹣5 , 则认为这个反应很难进行.已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10﹣36;H2S:K a1=1.3×10﹣7 , K a2=7.1×10﹣15 ,
通过计算说明反应CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq)进行的程度 .