��Ŀ����
����Ŀ����ͼ��һ���绯ѧ���̵�ʾ��ͼ�� 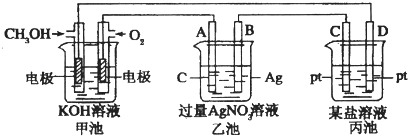
��ش��������⣺
��1��ͼ�м׳������ԭ��ء������ء���Ƴء�����
��2��A��ʯī���缫���������������������������������������������
��3��д��ͨ��CH3OH�ĵ缫�ĵ缫��Ӧʽ
��4���ҳ��з�Ӧ�Ļ�ѧ����ʽΪ���ҳ���B��Ag������������5.4g���׳�������������O2�����ΪL����״��������ʱ������ij�缫����1.6gij������������е�ij����Һ������ A��MgSO4B��CuSO4 C��NaCl D��AgNO3 ��
���𰸡�
��1��ԭ���
��2������
��3��CH3OH+8OH����6e��=CO32��+6H2O
��4��4AgNO3+2H2O ![]() 4Ag+O2��+4HNO3��0.28��BD
4Ag+O2��+4HNO3��0.28��BD
���������⣺��1���׳����Է��Ľ���������ԭ��Ӧ����������ԭ��أ����Դ��ǣ�ԭ��أ���2�����ǵ��أ���Ϊԭ��أ�ͨ��������������A������������Ϊ�����е����������Դ��ǣ���������3��ȼ�ϵ���У�������ͨ��ȼ�ϣ����������£��״�ˮ�к����������ӷ�Ӧ����̼������Ӻ�ˮ�����Ե缫��ӦʽΪ��CH3OH+8OH����6e��=CO32��+6H2O�� ���Դ��ǣ�CH3OH+8OH����6e��=CO32��+6H2O����4���ҳ��ǵ��أ�̼���������������������Է�Ӧ�ǵ����������Һ����ط�ӦʽΪ��4AgNO3+2H2O ![]() 4Ag+O2��+4HNO3 �� �ҳ��ǵ��أ�B���������ӵõ��ӷ�����ԭ��Ӧ��������������ת�Ƶ�����ȣ����ҳ���B������������5.4gʱ���׳�������������O2�����=
4Ag+O2��+4HNO3 �� �ҳ��ǵ��أ�B���������ӵõ��ӷ�����ԭ��Ӧ��������������ת�Ƶ�����ȣ����ҳ���B������������5.4gʱ���׳�������������O2�����= ![]() ��22.4L/mol=0.28L��
��22.4L/mol=0.28L��
�����ǵ��أ������Ͻ������ӷŵ������������ʣ������Ԫ������Ԫ��֮��D�缫���Ӽ״��缫������D������������ת�Ƶ������֪��������һ�۽���ʱ����Ħ������= ![]() =32g/mol�����������ȫ����ʱ������������������ת�Ƶ�������ȣ��������Ľ���Ħ����������32g/mol����D��ȷ��
=32g/mol�����������ȫ����ʱ������������������ת�Ƶ�������ȣ��������Ľ���Ħ����������32g/mol����D��ȷ��
���������Ƕ��۽�������![]() =64g/mol�����Ըý�����ͭ������Һ������ͭ��Һ����ѡBD��
=64g/mol�����Ըý�����ͭ������Һ������ͭ��Һ����ѡBD��
���Դ��ǣ�4AgNO3+2H2O ![]() 4Ag+O2��+4HNO3��0.28��BD��
4Ag+O2��+4HNO3��0.28��BD��

 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�����Ŀ���о������к������Ҫ��SO2��H2S����ת���Ի�������������Ҫ���壮
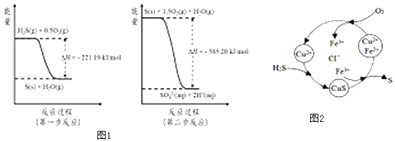
��1��SO2�Ĵ����ŷŻ��������صĻ��������� �� ��ʪ�����£�д��������SO2ת��ΪHSO3���ķ���ʽ ��
��2�������е�����ɽ�������H2S��������Ӧ������SO42�� �� ������Ӧ�������仯ʾ��ͼ1���£�
1mol H2S��g��ȫ��������SO42����aq�����Ȼ�ѧ����ʽΪ
��3��SO2�ǹ�ҵ�������ԭ������֮һ��һ���¶��£����ݻ�Ϊ2L���ܱ������г���һ������SO2��O2 �� ������Ӧ��2SO2��g��+O2��g��2SO3��g���������вⶨ�IJ������ݼ�����
ʱ��/min | n��SO2��/mol | n��O2��/mol |
0 | 0.10 | 0.050 |
4 | 0.050 | 0.025 |
5 | 0.040 | |
8 | 0.020 |
�ٷ�Ӧ��0��4min�ڵ�ƽ������Ϊv��SO2��=��
�ڴ��¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K= ��
��8minʱ��ά���¶Ȳ��䣬����Ӧ��������ͨ��0.020mol SO2��g����0.010mol O2��g�������´ﵽƽ��ʱ���������SO2�İٷֺ����������С�����������䡱������4����H2S �Ϳ����Ļ������ͨ��FeCl3��FeCl2��CuCl2�Ļ����Һ�з�Ӧ����S��������ת����ͼ2��ʾ��
�����¶�һ���Ͳ�������Һ�������£�����ͨ�������壬����ֽ��裮��ʹ���ɵ������в���CuS���ɲ�ȡ�Ĵ�ʩ�� ��
��һ����˵�����һ����Ӧ��ƽ�ⳣ������105 �� ͨ����Ϊ��Ӧ���еý���ȫ���෴�����һ����Ӧ��ƽ�ⳣ��С��10��5 �� ����Ϊ�����Ӧ���ѽ��У���֪�����¸����ʵ��ܶȻ�������ƽ�ⳣ����
CuS��Ksp=6.3��10��36��H2S��K a1=1.3��10��7 �� K a2=7.1��10��15 ��
ͨ������˵����ӦCuS��s��+2H+ ��aq��=Cu2+��aq��+H2S��aq�����еij̶� ��