题目内容
【题目】氨气是一种重要的化工原料,在工农业中都有广泛的应用。
(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式如下:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)。某实验小组向一个容积不变的真空密闭容器中充入![]() 与
与![]() 合成尿素。在恒定温度下,混合气体中
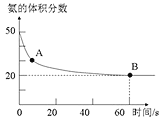
合成尿素。在恒定温度下,混合气体中![]() 的含量随时间的变化关系如图所示
的含量随时间的变化关系如图所示![]() 该条件下尿素为固体
该条件下尿素为固体![]() 。A点的正反应速率
。A点的正反应速率![]() ______ B点的逆反应速率
______ B点的逆反应速率![]() 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于”![]() ,
,![]() 的平衡转化率为______。
的平衡转化率为______。
(2)氨基甲酸铵![]() 是合成尿素过程中的中间产物。现将体积比为2:1的
是合成尿素过程中的中间产物。现将体积比为2:1的![]() 和
和![]() 混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:
混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:![]() 。实验测得在不同温度下的平衡数据如表:
。实验测得在不同温度下的平衡数据如表:
温度 |
|
|
|
|
|
平衡气体总浓度 |
|
|
|
|
|
①上述反应的焓变:![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”,下同
”,下同![]() ,熵变
,熵变![]() ______
______![]() 根据表中数据,列出
根据表中数据,列出![]() 时该反应的化学平衡常数的计算式
时该反应的化学平衡常数的计算式![]() ______
______![]() 不要求计算结果
不要求计算结果![]() 。
。
②若从已达平衡状态的上述容器中分离出少量的氨基甲酸铵晶体,反应物的转化率将______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
(3)向含![]() 的溶液中滴加bL氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将______
的溶液中滴加bL氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将______![]() 填“正向”、“不”或“逆向”
填“正向”、“不”或“逆向”![]() 移动,所滴加氨水的浓度为______
移动,所滴加氨水的浓度为______ ![]() 时,
时,![]() 的电离平衡常数
的电离平衡常数 ![]()
【答案】![]()
![]()
![]()
![]()
![]() 不变 逆向
不变 逆向 ![]()
【解析】
(1)图象分析氨气的体积分数从50%变化为20%后体积分数保持不变,说明B点反应达到平衡状态,A点氨气体积百分含量大于B的氨气体积百分含量,说明反应正向进行达到平衡状态,A点的正反应速率大于B点的正反应速率;依据氨气的体积分数结合平衡三段式列式计算平衡转化率;
(2)①根据表中的数据温度越高,则平衡气体的总浓度越大,所以升高温度,平衡逆向移动,正反应反应是放热反应;
反应物是气体,产物是固体,该反应是熵减小的过程;
根据平衡三段式计算各物质的平衡浓度,再根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行列式;
③固体量的变化,对平衡不产生影响;
(3)一水合氨对铵根离子水解起到抑制作用;
依据一水合氨的电离平衡常数计算得到氨水浓度。
(1)根据图知,从A到B点过程中氨气的体积分数逐渐减小,平衡正向移动,则B点后氨气体积分数不变,反应达到平衡状态,氨气体积分数越大其反应速率越快,氨气体积分数![]() ,则
,则![]() ;
;
设氨气消耗物质的量x,开始氨气体积分数为![]() ,假设氨气为50mol,二氧化碳为50mol,
,假设氨气为50mol,二氧化碳为50mol,
可逆反应 ![]()
开始![]() 50 500
50 500
消耗![]()
![]() x
x![]()
平衡![]()
![]()
![]()
![]()
氨气的体积分数![]() ;解得
;解得![]() span>,
span>,
![]() 的平衡转化率
的平衡转化率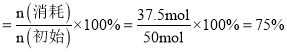 ,
,
故答案为:![]() ;
;![]() ;
;
(2)①根据表中的数据温度越高,则平衡气体的总浓度越大,所以升高温度,平衡逆向移动,正反应反应是放热反应,故![]() ;反应物是气体,产物是固体,该反应是熵减小的过程,即,
;反应物是气体,产物是固体,该反应是熵减小的过程,即,![]() ,反应
,反应![]() ,设二氧化碳浓度的变化量x,加入反应物的物质的量之比等于其计量数之比,则反应物的转化率相等,所以平衡时
,设二氧化碳浓度的变化量x,加入反应物的物质的量之比等于其计量数之比,则反应物的转化率相等,所以平衡时![]() 和
和![]() 的物质的量浓度之比为2:1,设平衡时
的物质的量浓度之比为2:1,设平衡时![]() 和
和![]() 的物质的量浓度分别为
的物质的量浓度分别为![]() 、
、![]() ,则
,则![]() ,即
,即![]() ,
,![]() ,化学平衡常数
,化学平衡常数![]() ,
,
故答案为:![]() ;
;![]() ;
;![]() ;
;
②固体不影响平衡移动,氨基甲酸铵晶体是固体,其量的多少不影响平衡移动,所以减少氨基甲酸铵晶体质量对平衡不产生影响,故反应物的转化率将不变,
故答案为:不变;
(3)滴加氨水过程中![]() 增大而抑制一水合氨电离,则水的电离平衡逆向移动;
增大而抑制一水合氨电离,则水的电离平衡逆向移动;
将![]() 溶于水,向该溶液滴加bL氨水后溶液呈中性,则
溶于水,向该溶液滴加bL氨水后溶液呈中性,则![]() ,根据电荷守恒得
,根据电荷守恒得![]() ;设混合后溶液体积为1L,则
;设混合后溶液体积为1L,则![]() ,设原来氨水浓度为
,设原来氨水浓度为![]() ,则混合溶液中
,则混合溶液中![]() ,,
,,![]() 的电离平衡常数取
的电离平衡常数取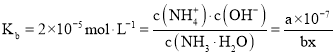 ,
,![]() ,
,
故答案为:逆向;![]() 。
。

 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案【题目】按要求回答下列问题:
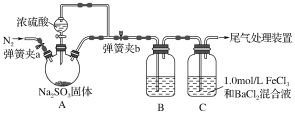
Ⅰ.(1)将NaHSO4溶液滴入到Ba(OH)2溶液中至中性的离子方程式:_______
(2)将5-6滴饱和氯化铁溶液滴入到25mL沸水中,继续加热,得红褐色液体。写出反应的离子方程式:______________
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。又变为棕黄色的原因是____________(用离子方程式表示)。
(4)向Na2S2O3 中加入稀硫酸反应的离子方程式______________。
Ⅱ.金属铬(Cr)的英文是Chromium,原意是颜色,因为它的化合物都有美丽的颜色。如表是几种常见铬的化合物或离子的水溶液的颜色:
离子或化合物 | Cr2O | Cr(OH)3 | Cr3+ | CrO2- | CrO |
颜色 | 橙色 | 灰蓝色 | 蓝紫色 | 绿色 | 黄色 |
含铬元素的化合物可以发生如图一系列变化:
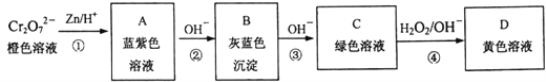
①写出反应④的离子方程式:___________________。
②结合上述转化图及所学知识,请分析向NaCrO2溶液中逐滴加入过量稀硫酸的现象为_______。
Ⅲ.二氧化硫是常见大气污染气体,二氧化硫尾气处理的方法之一是采用钠一钙联合处理法。
第一步:用NaOH溶液吸收SO2:2NaOH+SO2=Na2SO3+H2O
第二步:将所得的Na2SO3溶液与生石灰反应Na2SO3+CaO+H2O=CaSO3↓+2NaOH
若在第一步吸收SO2后得到的NaOH和Na2SO3混合溶液中,加入少许溴水,振荡后溶液变为无色,生成Na2SO4和NaBr。写出发生反应的离子方程式____________
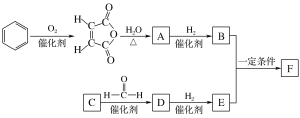
【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应