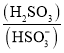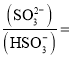题目内容
【题目】已知反应CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )
CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )
A.升高温度,K增大
B.减小压强,n(CO2)增加
C.更换高效催化剂,α(CO)增大
D.充入一定量的氮气,n(H2)不变
【答案】D
【解析】
A. ΔH<0,正反应放热,升高温度平衡向逆反应方向移动,平衡常数减小,K减小,故A错误;
B. 比较方程式气体的计量数关系,反应前气体的化学计量数之和等于反应后气体的计量数之和,则减小压强,平衡不移动,n(CO2)不变,故B错误;
C. 催化剂能改变反应速率,但不会引起化学平衡的移动,所以α(CO)不变,故C错误;
D. 充入一定量的氮气,相当于混合气体压强减小,平衡向气体体积增大的方向移动,但该反应前后气体体积不变,平衡不移动,n(H2)不变,故D正确;
答案选D。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案【题目】以含锂电解铝废渣(主要成分为LiF、AlF3、NaF,少量CaO等)为原料,生产碳酸锂的工艺流程如下:(已知:常温下,LiOH可溶于水,Li2CO3微溶于水)
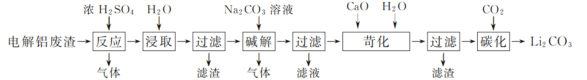
(1)含锂电解铝废渣与浓硫酸在200~400 ℃条件下反应2 h,加水浸取后过滤,得到的滤渣主要成分是________(填化学式)。
(2)流程中浸取后的过滤操作需要趁热在恒温装置中进行,否则会导致Li2SO4的收率下降,原因是________。(已知部分物质的溶解度数据见下表)
温度/℃ | Li2SO4/g | Al2(SO4)3/g | Na2SO4/g |
0 | 36.1 | 31.2 | 4.9 |
10 | 35.4 | 33.5 | 9.1 |
20 | 34.8 | 36.5 | 19.5 |
30 | 34.3 | 40.4 | 40.8 |
40 | 33.9 | 45.7 | 48.8 |
(3)40℃下进行碱解反应,得到粗碳酸锂与氢氧化铝的混合滤渣,生成氢氧化铝的离子方程式为________。
(4)苛化过程中加入的氧化钙将不溶性的碳酸锂转化成氢氧化锂溶液。若氧化钙过量,则可能会造成________。
(5)碳化反应中,CO2的吸收采用了气、液逆流的方式,这样做的优点是________。整个工艺流程中可以循环利用的物质有________。
【题目】氨气是一种重要的化工原料,在工农业中都有广泛的应用。
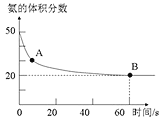
(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式如下:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)。某实验小组向一个容积不变的真空密闭容器中充入![]() 与
与![]() 合成尿素。在恒定温度下,混合气体中
合成尿素。在恒定温度下,混合气体中![]() 的含量随时间的变化关系如图所示
的含量随时间的变化关系如图所示![]() 该条件下尿素为固体
该条件下尿素为固体![]() 。A点的正反应速率
。A点的正反应速率![]() ______ B点的逆反应速率
______ B点的逆反应速率![]() 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于”![]() ,
,![]() 的平衡转化率为______。
的平衡转化率为______。
(2)氨基甲酸铵![]() 是合成尿素过程中的中间产物。现将体积比为2:1的
是合成尿素过程中的中间产物。现将体积比为2:1的![]() 和
和![]() 混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:
混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:![]() 。实验测得在不同温度下的平衡数据如表:
。实验测得在不同温度下的平衡数据如表:
温度 |
|
|
|
|
|
平衡气体总浓度 |
|
|
|
|
|
①上述反应的焓变:![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”,下同
”,下同![]() ,熵变
,熵变![]() ______
______![]() 根据表中数据,列出
根据表中数据,列出![]() 时该反应的化学平衡常数的计算式
时该反应的化学平衡常数的计算式![]() ______
______![]() 不要求计算结果
不要求计算结果![]() 。
。
②若从已达平衡状态的上述容器中分离出少量的氨基甲酸铵晶体,反应物的转化率将______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
(3)向含![]() 的溶液中滴加bL氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将______
的溶液中滴加bL氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将______![]() 填“正向”、“不”或“逆向”
填“正向”、“不”或“逆向”![]() 移动,所滴加氨水的浓度为______
移动,所滴加氨水的浓度为______ ![]() 时,
时,![]() 的电离平衡常数
的电离平衡常数 ![]()
【题目】以SO2、软锰矿(主要成分MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4溶液和Mn3O4,主要实验步骤如下:

步骤Ⅰ:如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2 = MnSO4)。
步骤Ⅱ:充分反应后,在不断搅拌下依次向三口烧瓶中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅等重金属。
步骤Ⅲ:过滤得MnSO4溶液。
(1)装置A用于制取SO2,反应的化学方程式为_____。
(2)装置B中反应应控制在90~100℃,适宜的加热方式是_____。
(3)装置C的作用是_____。
(4)“步骤Ⅱ”中加入纯净MnO2的目的是_____,用MnCO3调节溶液pH时,需调节溶液pH范围为_____(该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下)。
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀pH | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全pH | 9.18 | 3.27 | 4.9 | 10.2 |
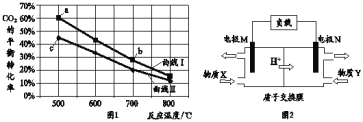
(5)已知:①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2![]() 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
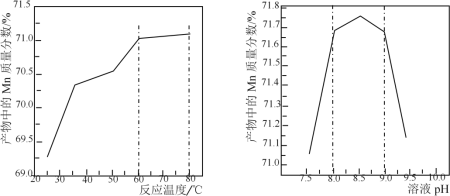
②反应温度超过80℃时,Mn3O4产率开始降低。
③Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.03%、62.5%。
请补充完整由步骤Ⅲ得到的MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:_____,真空干燥6小时得产品Mn3O4。