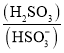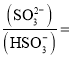题目内容
【题目】生物降解高分子材料F的合成路线如下,已知C是密度为1.16 g·L-1的烃。
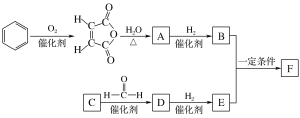
已知:
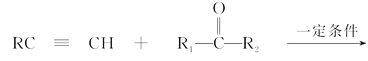
(1)下列说法正确的是________。
A.A能使酸性KMnO4溶液或溴的CCl4溶液褪色
B.等物质的量的B和乙烷,完全燃烧,消耗的氧气相同
C.E能和Na反应,也能和Na2CO3反应
D.B和E反应,可以生成高分子化合物,也可以形成环状物
(2)C中含有的官能团名称是________。
(3)由B和E合成F的化学方程式是____________________________________。
(4)完成由CH2=CH2、HCHO合成H3COOCCH2CH2COOCH3合成路线_____________(用流程图表示,无机试剂任选)。
(5) 的同分异构体中,分子中含1个四元碳环,但不含—O—O—键。结构简式是________。
的同分异构体中,分子中含1个四元碳环,但不含—O—O—键。结构简式是________。
【答案】ABD 碳碳三键 nHOOCCH2CH2COOH+nHOCH2CH2CH2CH2OH![]()
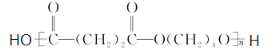 +(2n-1)H2O
+(2n-1)H2O 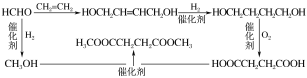
![]()
【解析】
C是密度为1.16 g·L-1的烃,则M=![]() Vm=1.16 g·L-1
Vm=1.16 g·L-1![]() 22.4L/mol=26g/mol,C为乙炔,根据已知反应的可知乙炔与甲醛反应生成D为HOCH2C
22.4L/mol=26g/mol,C为乙炔,根据已知反应的可知乙炔与甲醛反应生成D为HOCH2C![]() CCH2OH,D催化加氢得E为HOCH2CH2CH2CH2OH;苯催化氧化生成
CCH2OH,D催化加氢得E为HOCH2CH2CH2CH2OH;苯催化氧化生成![]() ,
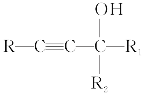
,![]() 与水在加热条件下反应生成A为HOOCCH=CHCOOH,HOOCCH=CHCOOH催化加氢得B为HOOCCH2CH2COOH;HOOCCH2CH2COOH与HOCH2CH2CH2CH2OH在一定条件下发生缩聚反应生成F为
与水在加热条件下反应生成A为HOOCCH=CHCOOH,HOOCCH=CHCOOH催化加氢得B为HOOCCH2CH2COOH;HOOCCH2CH2COOH与HOCH2CH2CH2CH2OH在一定条件下发生缩聚反应生成F为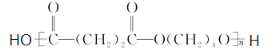 ,据此分析。
,据此分析。
根据上述分析可知:
(1)A.A是HOOCCH=CHCOOH,官能团中碳碳双键,能使酸性KMnO4溶液或溴的CCl4溶液褪色,选项A正确;
B.B的分子式是C4H6O4,碳氧抵消后为C2H6,完全燃烧消耗的氧气和等物质的量的乙烷相同,选项B正确;
C.E中有—OH,能和Na反应,不能和Na2CO3反应,选项C错误;
D.B和E中都是双官能团,也可以形成环状物,也可以形成高分子化合物,选项D正确。
答案选ABD;
(2)从以上分析可知,C是乙炔,含有的官能团名称是碳碳三键;
(3)由B和E合成F是缩聚反应,化学方程式是nHOOCCH2CH2COOH+nHOCH2CH2CH2CH2OH![]()
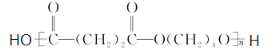 +(2n-1)H2O;
+(2n-1)H2O;
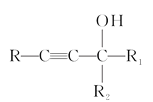
(4)题目中要求用CH2=CH2、HCHO制取H3COOCCH2CH2COOCH3,用倒推法应有H3COH和HOOCCH2CH2COOH,已知:RC≡CH+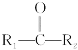
![]()
 ,甲醇由甲醛氢化还原制取,则合成路线为
,甲醇由甲醛氢化还原制取,则合成路线为 ;
;
(5)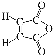 的同分异构体满足:分子中含1个四元碳环,但不含—O—O—键。结构简式是
的同分异构体满足:分子中含1个四元碳环,但不含—O—O—键。结构简式是![]() 等。
等。

【题目】氨气是一种重要的化工原料,在工农业中都有广泛的应用。
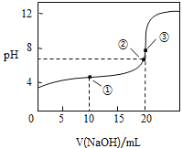
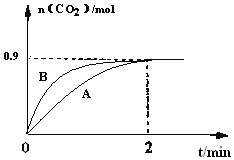
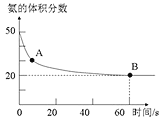
(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式如下:2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)。某实验小组向一个容积不变的真空密闭容器中充入![]() 与
与![]() 合成尿素。在恒定温度下,混合气体中
合成尿素。在恒定温度下,混合气体中![]() 的含量随时间的变化关系如图所示
的含量随时间的变化关系如图所示![]() 该条件下尿素为固体
该条件下尿素为固体![]() 。A点的正反应速率
。A点的正反应速率![]() ______ B点的逆反应速率
______ B点的逆反应速率![]() 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于”![]() ,
,![]() 的平衡转化率为______。
的平衡转化率为______。
(2)氨基甲酸铵![]() 是合成尿素过程中的中间产物。现将体积比为2:1的
是合成尿素过程中的中间产物。现将体积比为2:1的![]() 和
和![]() 混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:
混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:![]() 。实验测得在不同温度下的平衡数据如表:
。实验测得在不同温度下的平衡数据如表:
温度 |
|
|
|
|
|
平衡气体总浓度 |
|
|
|
|
|
①上述反应的焓变:![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”,下同
”,下同![]() ,熵变
,熵变![]() ______
______![]() 根据表中数据,列出
根据表中数据,列出![]() 时该反应的化学平衡常数的计算式
时该反应的化学平衡常数的计算式![]() ______
______![]() 不要求计算结果
不要求计算结果![]() 。
。
②若从已达平衡状态的上述容器中分离出少量的氨基甲酸铵晶体,反应物的转化率将______![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
(3)向含![]() 的溶液中滴加bL氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将______
的溶液中滴加bL氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将______![]() 填“正向”、“不”或“逆向”
填“正向”、“不”或“逆向”![]() 移动,所滴加氨水的浓度为______
移动,所滴加氨水的浓度为______ ![]() 时,
时,![]() 的电离平衡常数
的电离平衡常数 ![]()
【题目】破坏![]() 物质中的化学键所消耗的能量如表所示:
物质中的化学键所消耗的能量如表所示:
物质 |
|
|
|
|
|
|
|
能量/ | 243 | 193 | 151 | 431 | 363 | 297 | 436 |
根据上述数据回答下列问题。
(1)下列物质本身具有的能量最低的是________(填序号)。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
(2)下列氢化物中,最稳定的是________(填序号)。
A. ![]() B.
B. ![]() C.
C. ![]()
(3)相同条件下,![]() (
(![]() 代表
代表![]() 、
、![]() 、
、![]() )分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是________。
)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是________。